 |
Главная |
В. структурно-функциональная ОРГАНИЗАЦИЯ G-БЕЛКОВ
|
из
5.00
|
G-белки (ГТФ-связывающие белки) — универсальные посредники при передаче сигналов от рецепторов к ферментам клеточной мембраны, катализирующим образование вторичных посредников гормонального сигнала. G-белки - олигомеры, состоящие из α, β и γ-субъединиц. Состав димеров βγ незначительно различаются в разных тканях, но в пределах одной клетки все G-белки, как правило, имеют одинаковый комплект βγ-субъединиц. Поэтому G-белки принято различать по их α-субъединицам.. Выявлено 16 генов, кодирующих различные α-субъединицы G-белков. Некоторые из генов имеют более одного белка, вследствие альтернативного сплайсинга РНК.
Каждая α-субъединица в составе G -белка имеет специфические центры:
• связывания ГТФ или ГДФ;
• взаимодействия с рецептором;
• связывания с βγ-субъединицами;
• фосфорилирования под действием протеинкиназы С;
• взаимодействия с ферментом аденилатциклазой или фосфолипазой С.
В структуре G -белков отсутствуют α-спиральные, пронизывающие мембрану домены. G -белки относят к группе «заякоренных» белков (рис. 5-34).
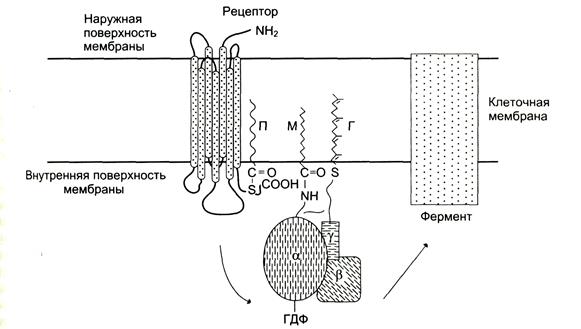
Рис. 5-34. Положение G-белков в мембране.Для ассоциации G-белков важно ацилирование α-протомеров алифатическими радикалами жирных кислот, миристиновой кислоты (М) или изопреновой. γ-Субъединица G-белка имеет геранил-геранильную группу (Г), связанную тиоэфирной связью с остатком цистеина С-конца.
Регуляция активностиG -белков
Различают неактивную форму G -белка - комплекс αβγ-ГДФ и активированную форму αβγ -ГТФ. Активация G-белка происходит при взаимодействии с комплексом активатор-рецептор, изменение конформации G-белка снижает сродство α-субъединицы к молекуле ГДФ и увеличивает к ГТФ. Замена ГДФ на ГТФ в активном центре G-белка нарушает комплементарность между α-ГТФ и βγ-субъединицами. Рецептор, связанный с сигнальной молекулой, может активировать большое количество молекул G-белка, таким образом обеспечивая усиление внеклеточного сигнала на этом этапе (рис. 5-35).
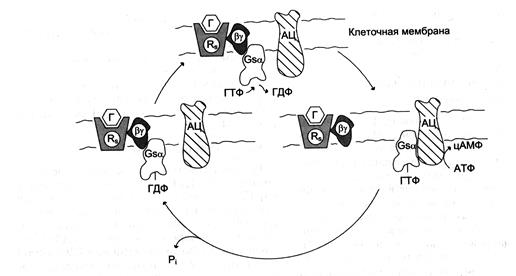
Рис. 5-35. Цикл функционирования G-белка.Rs — рецептор; Г — гормон; АЦ — аденилатциклаза.
Активированная α-субъединица G-белка (α-ГТФ) взаимодействует со специфическим белком клеточной мембраны и изменяет его активность. Такими белками могут быть ферменты аденилатциклаза, фосфолипаза С, фосфодиэстераза цГМФ, Na+-каналы, К+-каналы.
Следующий этап цикла функционирования G-белка — дефосфорилирование ГТФ, связанного с α-субъединицей, причём фермент, катализирующий эту реакцию, — сама α-субъединица.
Дефосфорилирование приводит к образованию комплекса α-ГДФ, который не комплементарен специфическому белку мембраны (например, аденилатциклазе), но имеет высокое сродство к βγ-протомерам. G-белок возвращается к неактивной форме — αβγ-ГДФ. При последующей активации рецептора и замене молекулы ГДФ на ГТФ цикл повторяется снова. Таким образом, α-субъединицы G-белков совершают челночное движение, перенося стимулирующий или ингибирующий сигнал от рецептора, который активирован первичным посредником (например, гормоном), на фермент, катализирующий образование вторичного посредника.
Некоторые формы протеинкиназ могут фосфорилировать α-субъединицы G-белков. Фосфорилированная α-субъединица не комплементарна специфическому белку мембраны, например, аденилатциклазе или фосфолипазе С, поэтому не может участвовать в передаче сигнала.
Г. аденилатциклаза
Фермент аденилатциклаза, катализирующий превращение АТФ в цАМФ (рис. 5-36), — ключевой фермент аденилатциклазной системы передачи сигнала. Аденилатциклаза обнаружена во всех типах клеток.
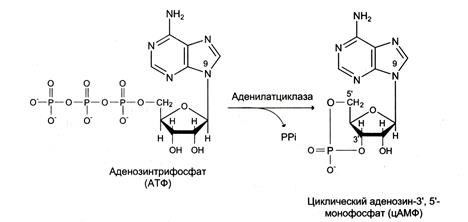
Рис. 5-36. Образование циклического аденозинмонофосфата (цАМФ).
Фермент относят к группе интегральных белков клеточной мембраны, он имеет 12 трансмембранных доменов. Внеклеточные фрагменты аденилатциклазы гликозилированы. Цитоплазматические домены аденилатциклазы имеют два каталитических центра, ответственных за образование цАМФ — вторичного по средника, участвующего в регуляции активности фермента протеинкиназы А.
На активность аденилатциклазы оказывают влияние как внеклеточные, так и внутриклеточные регуляторы. Внеклеточные регулятор (гормоны, эйкозаноиды, биогенные амины) осуществляют регуляцию через специфические рецепторы, которые с помощью α-субъединиц G-белков передают сигналы на аденилатциклазу. αs- Субъединица (стимулирующая) при взаимодействии с аденилатциклазой активирует фермент, αi- Субъединица (ингибирующая) ингибирует фермент. В свою очередь, аденилатциклаза стимурирует проявление ГТФ- фосфотазной активности α- субъединиц. В результате дефосфорилирования ГТФ образуются субъединицы аs-ГДФ и аi-ГДФ, не комплементарные аденилатциклазе.
Из 8 изученных изоформ аденилатциклазы 4 — Са2+-зависимые (активируются Са2+). Регуляция аденилатциклазы внутриклеточным кальцием позволяет клетке интегрировать активность двух основных вторичных посредников цАМФ и Са2+.
Д. фосфолипазы
Фосфолипазы — ферменты класса гидролаз, катализирующие катаболизм глицерофосфолипидов. Различают фосфолипазы секреторные, входящие в состав панкреатического сока, и клеточные фосфолипазы. Клеточные фосфолипазы А1 , А2, D, С различаются по специфичности к отщепляемой группе. Все фосфолипазы — кальций зависимые ферменты (рис. 5-37).
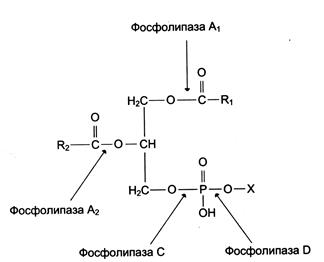
Рис. 5-37. Действие фосфолипаз.
Фосфолипаза С— фермент, гидролизующий фосфоэфирную связь в глицерофосфолипидах. В клетках человека идентифицировано 10 изоформ фосфолипазы С, различающихся по молекулярной массе, локализации, способу регуляции, субстратной специфичности. В структуре всех изоформ фосфолипазы С отсутствуют гидрофобные домены, которые могли бы обеспечить их взаимодействие с мембраной. Однако некоторые формы фосфолипазы С связаны с помощью гидрофобного «якоря» — ацильного остатка миристиновой кислоты или за счёт взаимодействия с поверхностью бислоя. Каталитическая активность всех изоформ фосфолипазы С зависит от ионов кальция.
Большинство фосфолипаз С специфично в отношении фосфатидилинозитолов и практически не гидролизует другие типы фосфолипидов. Активный фермент может гидролизовать до 50% от общего количества фосфатидилинозитолов клеточной мембраны. При гидролизе фосфатидилинозитол-4,5-бисфосфата (ФИФ2) образуются продукты диацилглицерол (ДАГ) и инозитол-1,4,5-трифосфат (ИФ3), служащие вторичными посредниками в трансмембранной передаче сигнала по инозитолфосфатному пути.
Е. протеинкиназы
Все полярные сигнальные молекулы, действующие на клетку-мишень через мембранные рецепторы, осуществляют свою биологическую функцию путём фосфорилирования специфических белков и ферментов, регулирующих метаболизм в клетке. Фосфорилирование изменяет (увеличивает или уменьшает) их активность. Катализируют фосфорилирование белков (протеинов) протеинкиназы по аминокислотным остаткам серина, треонина, тирозина. Протеинкиназы могут быть субъединицей мембранного рецептора, например тирозиновая протеинкиназа рецептора инсулина, активность которой регулируется гормоном. Другая группа — протеинкиназы, регулируемые вторичными вестниками гормонального сигнала (цАМФ, цГМФ, Са2+, ДАГ), например протеинкиназа А, протеинкиназа С, протеинкиназа G, кальмодулинзависимые протеинкиназы и др.
Протеинкиназы А
Протеинкиназы А (цАМФ-стимулируемые) участвуют в аденилатциклазной системе передачи сигнала. Протеинкиназа А состоит из 4 субъединиц R2С2 — двух регуляторных субъединиц (R2) и двух каталитических (С2) (см. рис. 5-41). Комплекс R2С2 не обладает ферментативной активностью.
Комплекс R2С2 разными способами прикрепляется к мембране. Некоторые формы протеинкиназы А «заякориваются» с помощью алифатического остатка миристиновой кислоты каталитических субъединиц. Во многих тканях протеинкиназа А связана с «заякоренным» белком АКАРs (от англ. сАМР dependent protein kinase anchoring proteins). АКАРs имеет центр связывания для регуляторных субъединиц протеинкиназы А. С помощью белка АКАРs протеинкиназа А связывается с мембраной в области локализации ферментов, катализирующих образование цАМФ (аденилатциклаза) или его гидролиз (фосфодиэстераза), а также белков, в регуляции активности которых фермент принимает участие, например потенциалзависимые Са2+-каналы.
Регуляторные субъединицы протеинкиназы А имеют специфические центры для связывания цАМФ. Присоединение цАМФ к регуляторным, субъединицам приводит к изменению конформации последних и снижению сродства к каталитическим субъединицам С, происходит диссоциация по схеме:
цАМФ4 + R2С2 -> цАМФ4 R2 + С + С
Субъединицы С представляют собой активную форму протеинкиназы А, которая катализирует реакции фосфорилирования по серину и треонину. Каталитические субъединицы С у разных типов протеинкиназ а не идентичны, они различаются прежде всего специфичностью в отношении белков-субстратов.
Протеинкиназы С
Протеинкиназы С участвуют в инозитолфосфатной системе передачи сигнала. Фермент состоит из двух функционально различных доменов — регуляторного и каталитического. Регуляторный домен содержит 2 структуры («цинковые пальцы»),образованные фрагментами пептидной цепи, богатыми цистеином, и содержащими 2 иона цинка (см. раздел 1). «Цинковые пальцы» участвуют в связывании диацилглицерола. Другой фрагмент регуляторного домена имеет высокое сродство к Са2+. Повышение концентрации кальция в цитозоле увеличивает сродство протеинкиназы С к фосфатидилсерину мембраны. Транслокация протеинкиназы С к мембране позволяет ферменту связаться с ДАГ, который ещё больше повышает сродство протеинкиназы С к ионам кальция (рис. 5-38). Наиболее распространённые изоформы протеинкиназы С активируются Са2+, диацилглицеролом и фосфатидилсерином.

.5-38. Регуляция активности протеинкиназы С (ПКС). ФС — фосфатидилсерин; ДАГ — диаципглицерол.
Каталитический домен имеет центр, связывающий АТФ и белок-субстрат. Активная фермента протеинкиназы С фосфорилирует по остаткам серина и треонина. Снижение концентрации ионов кальция в клетке нарушает связь протеинкиназы С с фосфатидилсерином и диацилглицеролом, фермент переходит в неактивную форму и отделяется от мембраны.
3. ПротеинкиназыG
В отличие от протеинкиназы А, протеинкиназа G присутствует не во всех тканях, ее обнаруживают в лёгких, мозжечке, гладких мышцах и тромбоцитах. Изоформы протеинкиназы G могут быть связаны с мембраной или находиться цитоплазме. Растворимая протеинкиназа С состоит из двух идентичных субъединиц, каждая из которых имеет два центра для связывания цГМФ. Приединение цГМФ к регуляторным центрам вызывает конформационные изменения субъединиц и повышает каталитическую активность фермента (рис. 5-39). Протеинкиназа G, подобно протеинкиназе А и С, специфична в отношении определённых белковых субстратов, которые она фосфорилирует по остаткам серина и треонина.
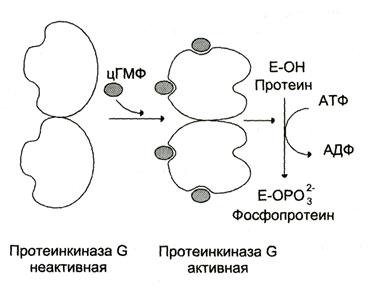
Рис. 5-39. Регуляция активности протеинкиназы G (ПКG).
Ж фосфодиэстеразы
Фосфодиэстеразы — ферменты, катализирующие превращение цАМФ (рис. 5-40) или цГМФ в неактивные метаболиты АМФ или ГМФ. Фосфодиэстеразы, снижая концентрации вторичных посредников, разрывают цепь превращений, вызванных активатором рецептора.
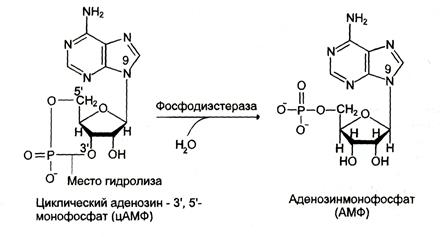
Рис.5-40. Превращение цАМФ в АМФ.
Фосфодиэстеразы присутствуют в клетках тканей в 2 формах: в форме растворимого белка и мембранносвязанного. Формы фермента, связанные с мембраной, в разных тканях составляют 5—40%. В одной и той же ткани могут присутствовать разные формы фосфодиэстеразы, различающиеся по сродству к субстратам, молекулярному весу, заряду, регуляторным свойствам и локализации в клетке.
Фосфодиэстеразы циклических нуклеотидов не обладают абсолютной специфичностью, поэтому, как правило, одна и та же форма фермента способна гидролизовать как цАМФ, так и цГМФ. Однако скорости гидролиза этих двух нуклеотидов под действием одной и той же фосфодиэстеразы могут значительно различаться. Это зависит от того, какая фосфодиэстераза присутствует в клетке — более специфичная в отношении цАМФ или более специфичная к цГМФ, от соотношения концентраций цАМФ и цГМФ в клетке и от действия регуляторов фосфодиэстеразы.
В большинстве тканей присутствует фосфодиэстераза-1, более специфичная к цАМФ, активируемая Са2+, комплексом 4 Са2+-кальмодулин и цГМФ.
|
из
5.00
|
Обсуждение в статье: В. структурно-функциональная ОРГАНИЗАЦИЯ G-БЕЛКОВ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

