 |
Главная |
Tobias J. W., T. E. Schrader, G. Rocap, 11 страница
|
из
5.00
|
116 ГЛАВА 6

| Рис. 6.9. Экспрессия плазмидного вектора с генетической конструкцией «ген тиоредоксина— ген белка-мишени» в отсутствие (А) и в присутствии (Б) триптофана. Стрелки, помеченные рТrp и pL-, указывают направление транскрипции. Сокращения и обозначения: oТгр оператор, с которым связывается репрессор tip: о1 - оператор, с которым связывается репрессор cI; pΤrp - trp-промотор, pL -левый промотор бактериофага λ; ТТ - сигнал терминации транскрипции. Между генами тиоредексина и белка-мишени находится нуклеотидная последовательность, которая кодирует пептид, расщепляемый энтерокиназой. Подковообразными кривыми изображено связывание репрессоров с соответствующими операторами. |
кодирующих последовательностей была сконструирована плазмида (фагмида), содержащая небольшой фрагмент ДНК M13, который обеспечивал ее упаковку in vitro в фаговые частицы. ген белка pIII под контролем какого-нибудь регулируемого бактериального промотора (например, lac-промотора Е. coli) и сайт клонирования вблизи 5'-конца гена рIII. После репликации рекомбинантного фага М13 в E. coli белок-мишень оказывался сшитым с N-концом фагового белка, и содержащие его бляшки можно было идентифицировать иммунологическими методами. Рекомбинантные фагмиды, выделенные из таких бляшек, могут служить источником соответствующей кДНК. Эта весьма эффективная селективная система позволяет обнаруживать кДНК редких, но очень важных белков.
Библиотеки, содержащие гены поверхностных бактериальных белков, можно использовать и для идентификации клонов, несущих специфические нуклеотидные последовательности. Чтобы включить искомый белок в поверхностные структуры грамотрицательной бактерии, например E. coli, сшивают его гены и гены белков этой структуры. В качестве бактериальных белков используются белок наружной мембраны А (ОгпрА) и пептидом и кансвязан-ный липопротеин (PAL) E. coli, а также белок F наружной мембраны Pseudomonas aeruginosa (OprF). При этом белок-мишень обычно находится либо на С-, либо на N-конце химерного белка, но иногда короткие полипептиды включаются в середину молекулы бактериального белка (рис. 6.10).
Оптимизация экспрессии генов, клонированных в прокариотических системах 117

|
| Рис. 6.10. Химерные белки, состоящие из поверхностного бактериального белка и чужеродного белка-мишени, присоединенного к его N- или С-концу (А) либо включенного в экспонируемые участки молекулы (Б). В обоих случаях чужеродные пептиды или белок оказываются на поверхности бактериальной клетки. |
Системы слияния с локализацией белков-мишеней на поверхности бактериальных клеток можно использовать также для суперпродукции некоторых белков и пептидов. Так, в одной из работ в участок, кодирующий основной белок наружной мембраны Pseudomonas aeruginosa (OprF), был встроен ген антигенного детерминанта возбудителя малярии Plasmodiutn falciраrит. Бактериальные клетки, синтезирующие соответствующий химерный белок, давали положительную реакцию с моноклональными антителами к P.falciparum. Следовательно, поверхностные химерные белки можно использовать в качестве вакцин (гл. 11).
Однонаправленное тандемное расположение генов
Обычно уровень генной экспрессии пропорционален числу копий транскрибируемого гена в хозяйских клетках. Отсюда следует, что с увеличением числа копий плазмиды должно увеличиваться и количество продукта встроенного в эту плазмиду гена. Однако помимо клонируемого гена плазмида содержит и другие транскрибируемые последовательности, например гены устойчивости к антибиотикам, и по мере увеличения ее копийности энергетические ресурсы клетки будут во все большей степени направляться на образование белков, кодируемых плазмидой, и метаболическая активность хозяйской клетки упадет. Выходом из этой ситуации могло бы стать встраивание в малокопийную плазмиду нескольких копий интересующего исследователя гена. Однако при этом возникает одна техническая проблема — расположение генов в такой ориентации, чтобы все они могли правильно транскрибироваться и транслироваться. Простое сшивание «конец-в-конец» приводит к случайной ориентации генов, так что одни из них экспрессируются, а другие, находящиеся в противоположной ориентации, — нет (рис. 6.11).
Чтобы решить эту проблему можно использовать рестрицирующий фермент AvaI, который узнает последовательность CTCGGG и разрезает ДНК с 5'-конца от остатка Т. Процедура состоит в следующем. Плазмиду, содержащую эту последовательность, разрезают с помощью AvaI и. используя ДНК-полимеразу I, достраивают липкие концы. Затем к обоим ее тупым концам пристраивают EcoRI-линкер (GAATTC), вновь замыкая кольцо. Получившаяся плазмида содержит сегмент ДНК с двумя AvaI-сайтами, фланкирующими EcoRI-сайт и перекрывающимися с ним (рис. 6.12, А и Б), т. е. последовательность CTCGGG AATTCTCGGG (здесь подчеркнутые основания — сайты узнавания для AvaI). Нужный ген вместе с трансляционными старт-и стоп-сигналами встраивают в EсоRI-сайт и затем вырезают из плазмиды с помощью AvaI (рис. 6.12, В). Такие фрагменты имеют неидентичные липкие концы, и поэтому при последующем сшивании соединяются в одной ориентации. Подобный набор однонаправленных тандемных копий гена может быть встроен в экспрессирую-щий вектор. При этом тандемная последовательность может находиться в двух ориентациях относительно промотора, так что ее экспрессия будет происходить только в 50% случаев.
118 ГЛАВА 6

|
| Рис. 6.11. Образование случайно ориентированных тандемных повторов. А. Клонированные гены вырезают из клонирующего вектора с помощью рестрицируюшей эндонуклеазы АbсIи отделяют от векторной ДНК. Б. Создают условия, при которых происходит сшивание вырезанных генов. Поскольку нуклеотидные последовательности обоих выступающих концов генов одинаковы, последние могут соединяться в любой ориентации. В результате образуются тандемные повторы из случайно ориентированных последовательностей. |
Другой подход основан на использовании синтетических ориентированных адаптеров -коротких олигодезоксинуклеотидов, присоединенных к концам линеаризованной плазмидной ДНК и к концам фрагментов ДНК с клонируемым геном. При лигировании эти фрагменты располагаются только в одной ориентации. Описанная процедура технически значительно более проста, чем та, в которой используется ре-стрицирующая эндонуклеаза AvaI; кроме того, она не требует, чтобы в гене-мишени отсутствовали AvaI- и EcoRI-сайты.
Уже показано экспериментально, что уровень экспрессии генов интерферона действительно увеличивается пропорционально числу тандемных копий гена, по крайней мере до четырех копий на плазмиду. Однако тандемные повторы иногда оказываются нестабильными и со временем некоторые из них или даже все утрачиваются плазмидой.
Трансляционные экспрессирующие векторы
Наличие сильного регулируемого промотора -это очень важное, но недостаточное условие максимизации количества продукта клонированного гена. Большую роль играют также эффективность трансляции и стабильность самого продукта. В прокариотических клетках разные мРНК не всегда транслируются с одинаковой эффективностью. Различие может составить несколько сотен раз, и в результате в клетке будут присутствовать сотни или даже тысячи копий одних белковых молекул и лишь несколько копий других.
Различия в трансляции связаны — по крайней мере частично — со свойствами имеющегося в транскрибированной РНК сигнала инициации трансляции, называемого сайтом связывания рибосомы. Сайт связывания рибосомы — это
Оптимизацияэкспрессии генов, клонированныхв прокариотических системах 119

|
| Рис. 6.12. Клонирование нескольких копий гена в одной плазмиде. А. Создание вектора. Плазмиду разрезают по AvaI-сайту и образовавшиеся липкие концы достраивают с помощью ДНК-полимеразы I E. coli. К тупым концам присоединяют EcoRI-линкер, замыкающий кольцо. Б. Встраивание EcoRI -линкера в AvaΙ-сайт в плазмиде. B. Образование однонаправленного тандемного повтора. |
| Рис. 6.13. Внутрицепочечное спаривание в молекуле мРНК, препятствующее эффективной трансляции. GGGGG — сайт связывания рибосомы, AUG (красные буквы) - инициаторный кодон, CAG-CAU-GAU-UUA-UUU — несколько первых кодонов. Обратите внимание, что кроме обычных для мРНК пар A-U и G-C иногда образуются пары G-U. | 
|
120 ГЛАВА 6

| |
| tac- Промотор: функциональный гибрид, полученный из trp- и lac- промоторов H. A. DeBoer, L J. Comstock, M. Yasser Proc. Nail. Acad. Sa. USA 80: 21-25, 1983 |
| Приступая к конструированию laс-промотора, Де Боер и его коллеги ставили своей целью создание на основе двух разных сильных регулируемых промоторов еще более сильного промотора, способного обеспечивать высокий уровень экспрессии чужеродных белков. Когда они начинали свои исследования, нуклеотидные последовательности большинства прока риотических промоторов, в первую очередь Е. coli, были уже установлены, однако конкретные свойства, обусловливающие их эффективность, оставались неизвестными. Было показано, что почти все мутации, влияющие на силу промотора, локализуются в —10- или в -35-областях (находя-шихся на расстоянии 10 или соответственно 35 п. н. до точки инициации транскрипции). Бо- | лее того, силу промотора увеличивали только те мутации, в результате которых нуклеотидные последовательности указанных областей приближались к консенсусным: 5'-ТАТААТ-3' для -10 и 5'-ТТСАСА-3' для -35 соответственно. Эти последовательности были получены в результате сравнения нуклестидных последовательностей всех известных промоторов и идентификации наиболее часто встречающихся нуклеотидов. Де Боеру было известно, что у промотора lacUV5, более сильного варианта lac-промотора, — 10-область имеет кон-сенсусную нуклеотидную последовательность, а — 35-область — нет, а у trр-промотора, в норме контролирующего транскрипцию генов, которые отвечают за биосинтез триптофана, ситуация | как раз обратная. Он и его коллеги решили сконструировать химерный промотор, у которого —10-область происходила бы от lac- промотора, а —35 — от промотора trр. Этот новый, так называемый taс-промотор был проверен на способность контролировать синтез фермента галактокиназы E. coli по сравнению с lac- и trp-промоторами в таких же условиях. Как и ожидалось, lac-промотор оказался гораздо более сильным — примерно в 5 раз по сравнению с промотором trp и в 10 — по сравнению с lac. Кроме того, laс-промотор, как и lac, реагировал на lас-репрессор и активировался под действием ИПТГ. Таким образом, новый промотор был не только более сильным, но и регулируемым. |
последовательность из шести-восьми нуклеотидов (например, UAAGGAGG), спаривающаяся с комплементарной последовательностью (в данном случае AUUCCUCC) РНК-компонента (рРНК) малой субъединицы рибосомы. Обычно чем прочнее связывание между мРНК и рРНК, тем выше эффективность инициации трансляции. Именно поэтому большинство экспресси-рующих Е. сoli-векторов конструируют таким образом, чтобы мРНК клонированного гена обязательно содержала сильный сайт связывания рибосомы. Это необходимое условие трансляции гетерологичных про- и эукариотических генов в E. coli. Однако должны соблюдаться и некоторые другие условия. Во-первых, нуклеотидная последовательность, связывающаяся с рРНК, должна находиться на определенном расстоянии от старт-кодона клонированного гена (в РНК старт-кодоном является AUG; в ДНК ему соответствует кодон ATG). Во-вторых, участок ДНК, содержащий сайт связывания рибосомы и несколько первых кодонов клонированного гена, не должен иметь такую нуклеотидную последовательность, при которой после транскрипции может произойти вну-трицепочечное спаривание (рис. 6.13), нарушающее связывание мРНК с рибосомой. Именно локальная вторичная структура мРНК, обеспечивающая экранирование или, напротив, экспонирование сайта связывания рибосомы, и определяет прочность связывания мРНК с комплементарной рРНК. Таким образом, при клонировании любого гена важно убедиться в том, что сайт связывания рибосомы расположен на нужном расстоянии от этого гена и что вторичная структура мРНК не помешает его присоединению к рибосоме.
Уже создано большое количество векторных систем, которые включают как транскрипционный, так и трансляционный сигналы, обеспечивающие экспрессию клонированных эукариотических генов в E. coli. Одной из таких систем
Оптимизация экспрессии генов, клонированных в прокариотическихсистемах 121
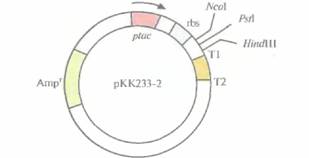
|
| Рис. 6.14. Экспрессирующий вектор на основе плазмиды рКК233-2 (без соблюдения масштаба). Он содержит ген устойчивости к ампициллину (Ampr), являющийся селективным маркером, lас-промотор (р(ас), lacZ-участок связывания рибосомы (rbs), три сайта для рестрицирующих эндонуклеаз (NcoI, PsAIи HindIII) и два сайта терминаиии транскрипции (Т1 и Т2). Стрелка — направление транскрипции. |
является экспрессирующий вектор рКК233-2,
содержащий следующие элементы (рис. 6.14):
• селективный маркер устойчивости к ампициллину
• tec-промотор
• lacZ-участок связывания рибосомы
• старт-кодон ATG, расположенный на расстоянии восьми нуклеотидов от сайта связывания рибосомы
• сайты терминации транскрипции Т1 и Т2 фага λ.
Клонируемый ген встраивают в NcoI-, PstI-или HindIII-сайт, расположенный между сайтом связывания рибосомы и сайтами терминации транскрипции. Если его рамка считывания не попадает «в ногу» с кодоном AUG, то необходимо произвести минимальную коррекцию. В этом случае после индукции и транскрипции происходит достаточно эффективная трансляция клонированного гена. Однако следует иметь в виду, что поскольку нуклеотидная последовательность, кодирующая N-концевой участок белка-мишени, у разных клонированных генов неодинакова, нельзя создать универсальный вектор, исключающий одноцепочечное спаривание мРНК при любых обстоятельствах. Поэтому ни одна из областей инициации трансляции, как бы она ни была оптимизирована, не может га-
рантировать эффективность трансляции всех клонированных генов. Таким образом, описанные выше экспрессирующие векторы - это только основа для создания оптимальной системы трансляции.
Эффективной трансляции может препятствовать и «несовместимость» клеток, обусловленная тем, что в клонируемом гене имеются кодоны, редко встречающиеся в геноме организма-хозяина. В таких случаях в хозяйской клетке может не доставать транспортных РНК (тРНК), узнающих редко используемые кодоны, что снижает выход продукта клонированного гена. Как решить эту проблему — не совсем понятно. Если продукт клонированного гена очень ценен, можно попытаться химически синтезировать такой вариант клонируемого гена, который состоит из кодонов, обычно используемых хозяйским организмом (оптимизация кодонов).
Стабилизация белков
Обычно время полужизни белков составляет от нескольких минут до нескольких часов. Такая вариабельность обусловливается различиями в числе дисульфидных связей в белковых молекулах и наличием или отсутствием на 5'-конце определенных аминокислот. Например, если к N-концу ß-галактозидазы присоединять разные аминокислоты, то время жизни модифицированного белка in vitro может варьировать от двух минут до более 20 часов (табл. 6.4). Аминокислоты, увеличивающие время жизни белков, можно включать в белки генноинженерными методами. Часто для стабилизации белка-мишени достаточно присоединить к N-концу всего
| Таблица 6.4. Время полужизни ß-галактозидаз, к N-концу которых присоединены разные аминокислоты1) | |
| Присоединенные аминокислоты | Время полужизни |
| Mel, Ser, Ala Thr, Val, Gly Ile, Glu Туr, Gln Pro Phe, Leu, Asp, Lys Arg | >20 ч >20 ч >30 мин ~ 10 мин ~7 мин ~3 мин ~2 мин |
| 1) По данным работы Bachmairelal., 1986, Science 234:179-186. |
122 ГЛАВА 6
один аминокислотный остаток. Долгоживущие белки накапливаются в клетках, что увеличивает конечный выход продукта. Это характерно как для эу-, так и для прокариот.
Однако стабильность белков может не только повышаться. Так, включение некоторых аминокислотных последовательностей во внутреннюю часть белковой молекулы делает ее более чувствительной к протеолитическому расщеплению. Такие последовательности обогащены остатками пролина (Р), глутаминовой кислоты (Е), се-рина (S) и треонина (Т), отсюда и их название -PEST-последовательности. Они часто бывают фланкированы кластерами из положительно заряженных аминокислот и, возможно, служат маркерами для протеаз. Стабильность белков, содержащих такие последовательности, можно было бы повысить, внося изменения в соответствующие гены. При этом, однако, необходимо позаботиться о том, чтобы не произошло нарушений функции белка-мишени.
Рост в условиях недостатка кислорода
E. coli и многие другие микроорганизмы, которые используются для экспрессии чужеродных белков, обычно растут только в присутствии кислорода. К сожалению, растворимость кислорода в водных средах ограничена, а по мере увеличения плотности культуры содержание растворенного кислорода в культуральной среде быстро падает. Более того, поскольку кислород растворяется очень медленно, эту проблему нельзя решить простым продуванием через среду воздуха или кислорода даже при интенсивном перемешивании. При уменьшении концентрации кислорода экспоненциальный рост замедляется и культура медленно переходит в стационарную фазу, характеризующуюся другим метаболическим статусом. Одним из последствий этого является образование в клетках протеиназ, которые могут расщеплять белок-мишень. Проблему аэрации культуральной среды пытались решить разными способами: изменением конструкции биореактора, повышением интенсивности продувания воздуха и перемешивания, добавлением в среду веществ, увеличивающих растворимость кислорода. Все это, однако, не привело ни к каким ощутимым результатам.
Применение хозяйских штаммов с дефицитом протеиназ
Один из возможных подходов к стабилизации чужеродных белков, синтезируемых E, coli, состоит в использовании хозяйских штаммов с дефицитом протеолитических ферментов. Однако здесь есть свои трудности. В клетках E. coli синтезируется по крайней мере 25 разных протеиназ, и только некоторые из них изучены на генетическом уровне. Кроме того, протеиназы выполняют в клетке очень важную функцию, разрушая чужеродные или дефектные белки и обеспечивая тем самым жизнеспособность клеток. В одной из работ были сконструированы штаммы, несущие мутации в одном или даже нескольких протеиназных генах, и чем более выражен был суммарный дефицит по протеиназам, тем хуже рос штамм. Таким образом, снижение протеиназной активности приводит к истощению клеточных ресурсов. И все же удалось создать штаммы E. coli, несущие мутации в гене сигма-фактора РНК-полимеразы, ответственного за синтез белков теплового шока (rpoН), и в гене протеиназы, необходимой для роста клеток при высоких температурах (degP), y которых удельная активность секретируемых белков была в 36 раз выше, чем у штаммов дикого типа. Это кажущееся увеличение было обусловлено снижением интенсивности протеолитического расшепления белков.
Бактериальный «гемоглобин»
Местообитанием некоторых штаммов грамотрицательных облигатных аэробных бактерий Vitreoscilla являются сильно обедненные кислородом непроточные водоемы. Чтобы получать нужное количество кислорода для роста и метаболизма, они синтезируют гемоглобиноподоб-ное вещество, связывающее кислород окружающей среды и увеличивающее концентрацию доступного кислорода в клетке. Когда ген, кодирующий этот белок, был введен в клетки E. coli, в последних сразу произошли серьезные изменения: повысился уровень синтеза клеточных и рекомбинантных белков, возросла эффективность протонных насосов, увеличилось количество образующегося АТР и его концентрация, особенно при низком содержании кислорода в среде. Чтобы такую стратегию можно было ис-
Оптимизация экспрессии генов, клонированных в прокариотических системах 123
пользовать применительно к другим хозяйским клеткам, необходимо, чтобы эти клетки не только эффективно экспрессировали «гемоглобиновый" ген Vitreoscilla, но и синтезировали гем -составляющую гемоглобиновой молекулы. Это позволит улучшить рост таких важных в коммерческом отношении бактерий, как Е. coli, Streptomyces lividansr Corynebacterium glutarnicum и Xanlhomonas maltophilia, а также осуществлять в них экспрессию чужеродных генов.
Интеграция чужеродной ДНК в хромосому хозяина
При наличии вклетке плазмиды часть энергетических ресурсов расходуется на ее репликацию, транскрипцию и синтез белков, которые она кодирует. При этом, как правило, многокопийные плазмиды требуют больше энергии, чем малоколийные, и в результате часть клеток в процессе роста популяции утрачивает плазмиды. Клетки, лишившиеся своих плазмид, обычно растут быстрее тех, в которых они сохранились, и в конечном счете оказываются в культуре преобладающими. По прошествии нескольких генераций это отражается на количестве синтезируемого продукта клонированного гена. Разработано по крайней мере два подхода к решению этой проблемы. В лабораторных условиях для сохранения плазмид клетки выращивают в присутствии антибиотиков или метаболитов, обеспечивающих рост только тех клеток, в которых есть плазмида. Однако добавление антибиотиков и какихто других веществ в культуры, выращиваемые в больших объемах, или в промышленные ферментеры приводит к значительному удорожанию конечного продукта. Особенно важно, чтобы клонированные гены сохранялись, не утрачиваясь и не передаваясь другим микроорганизмам, в том случае, когда сконструированный микроорганизм предназначен для использования вне стен лаборатории. Он должен не только оставаться эффективным, но и быть экологически безопасным. Включение клонированной ДНК в хромосомную ДНК хозяйского организма позволяет обойтись без плазмид и избежать утраты плазмидных генов.
При встраивании нужного гена в хромосомную ДНК хозяина нужно позаботиться о том, чтобы сайт интеграции не находился внутри гена, кодирующего важную клеточную функцию. Для этого чужеродный ген включают в заведомо несущественный сайт. Кроме того, для обеспечения эффективной экспрессии его помещают под контроль регулируемого промотора. Для интеграции в нужный сайт вводимый ген должен содержать нуклеотидную последовательность длиной не менее 50 нуклеотидов, сходную с таковой в хромосомной ДНК, в пределах которых и должен произойти физический обмен (рекомбинация) между двумя молекулами ДНК. Вкратце процесс интеграции состоит в следующем.
1. Идентификация подходящего сайта интеграции, т. е. сегмента хозяйской ДНК, последовательность которого может быть прервана без ущерба для функционирования клетки.
2. Выделение и клонирование всего хромосомного сайта интеграции или его части.
3. Встраивание нужного гена вместе с регулируемым промотором в клонированный сайт интеграции {рис. 6.15, А) или вблизи него (рис. 6.15, Б).
4. Перенос полученной генетической конструкции «хромосомный сайт интеграции/клонированный ген» в хозяйскую клетку в составе плазмиды, не способной к автономной репликации в клетках этого хозяина.
5. Отбор и сохранение тех хозяйских клеток, которые экспрессируют клонированный ген. Наследование клонированного гена возможно только в случае его интеграции в хромосому клеток хозяина.
Если клетка трансформирована нереплицируюшейся плазмидой, несущей клонированный ген в середине клонированного фрагмента с хромосомным сайтом интеграции, то может произойти спаривание между гомологичными нуклеотидными последовательностями плазмиды и хозяйской ДНК (рис. 6.15, А) и далее интеграция в результате двойного кроссинговера, осуществляемого ферментами клетки-хозяина. Альтернативный вариант - интеграция всей плазмидной ДНК в хромосому хозяина в результате одиночного кроссинговера (на рисунке не показано). Интеграция всей плазмиды может произойти и в том случае, если клонированный
124 ГЛАВА 6

| Рис. 6.15. Два способа интеграции клонированного в плазмиде гена в хромосому. А. Ген встроен в середину клонированного в плазмиде сегмента ab, гомологичного сегменту a'b' в хромосомной ДНК. В результате двойного кроссинговера (Χ-Х) клони- рованный ген оказывается в составе хромосомы. Б. Ген встроен вблизи клонированного в плазмиде сегмента с, гомологичного сегменту с' в хромосомной ДНК. В результате одиночного кроссинговера (X) происходит интеграция в хромосому всей плазмиды вместе с включенным в нее геном. |
ген встроен вблизи клонированного хромосомного сайта интеграции.
Для проверки эффективности интеграции клонированного гена использовали В. subtilis. Была сконструирована плазмида Е. соli, содержащая ген α-амилазы (фермента, участвуюшего в гидролизе крахмала) Bacillus amyloliquefaciens, встроенный в середину фрагмента ДНК из В. subtilis. Она была неспособна реплицироваться в этом микроорганизме, но ею можно было трансформировать клетки Б. sitbtilis. Обнаруженные трансформанты синтезировали α-амилазу, что свидетельствует об интеграции гена, кодирующего данный фермент, в хромосому В. subtilis, и о его функционировании. Отобранные рекомбинанты были устойчивы к ампициллину и хлорамфениколу. Поскольку оба гена устойчивости находились в плазмиде, было очевидно, что произошла одиночная рекомбинация, в результате которой вся плазмида включилась в хромосомную ДНК В. sitbtilis.
Чтобы увеличить число копий гена α-амилазы, локализованных в хромосоме В. subtilis, ис-
Оптимизация экспрессии генов, клонированных в прокариотических системах 125
ходные трансформанты выращивали в присутствии хлорамфеникола в высокой концентрации. В таких условиях выживали только те клетки, в которых происходила спонтанная дупликация интегрированной плазмиды. Клетки, отобранные по признаку устойчивости к хлорамфениколу, проверяли на активность α-амилазы (табл. 6.5). После такой процедуры были получены клетки, содержащие до 9 копий гена α-амилазы. Уровень ферментативной активности в клетках, содержащих α-амилазные гены в составе хромосомы, была гораздо выше, чем в том случае, когда эти гены находились в многокопийной плазмиде (от 20 до 40 копий на клетку) В. subtilts.
В одном из исследований несколько копий чужеродного гена было встроено в разные заранее выбранные сайты в хромосоме В. sitbtilis, при этом для каждой из копий использовалась двух-этапная процедура (рис. 6.16), На первом этапе
Таблица 6.5, Связь между числом копий гена α-амилазы и уровнем ее активности в клетках В. subtilis1)
| Число копий иа геном | Активность, ЕД на 1 мл культуры, находящейся в середине экспоненциальной фазы |
| Многокопийная плазмида |
1) По данным работы Kallio et al., I987. Appl. Micrcbiol. Biotechnol. 27: 64-71.
выбирали селективный маркерный ген (например, ген устойчивости к какому-либо антибиотику) и встраивали его в середину вполне определенного, но несущественного фрагмента хромосомной ДНК В. subtilis в составе плазмид-
| Рис. 6.16. Встраивание чужеродного гена в заранее выбранный сайт в хромосоме В. subtilis. На этапе 1 в хромосомную ДНК хозяйской клетки с помощью гомологичной рекомбинации встраивают маркерный ген. На этапе 2 маркерный ген замещают геном-мишенью. Аналогичную операцию повторяют для других сайтов. | 
|
126 ГЛАВА 6
|
из
5.00
|
Обсуждение в статье: Tobias J. W., T. E. Schrader, G. Rocap, 11 страница |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

