 |
Главная |
Способы изображения оптических изомеров
|
из
5.00
|
Способ изображения выбирается автором исключительно из соображений удобства передачи информации. На рисунке 1 изображения энантиомеров даны с помощью перспективных картинок. При этом принято связи, лежащие в плоскости изображения, рисовать сплошной линией; связи, уходящие за плоскость, - пунктиром; а связи, направленные к наблюдателю, - жирной линией. Такой способ изображения вполне информативен для структур с одним хиральным центром. Эти же молекулы можно изобразить в виде проекции Фишера. Данный способ был предложен Э.Фишером для более сложных структур (в частности, углеводов), имеющих два и более хиральных центра.





 |



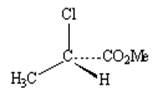
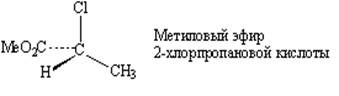



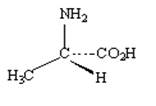
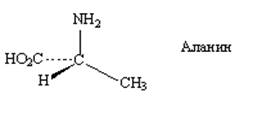




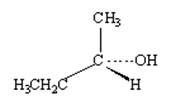

Зеркальная плоскость
Рис. 1
Для построения проекционных формул Фишера тетраэдр поворачивают так, чтобы две связи, лежащие в горизонтальной плоскости, были направлены к наблюдателю, а две связи, лежащие в вертикальной плоскости, - от наблюдателя. На плоскость изображения попадает только асимметрический атом. При этом сам асимметрический атом, как правило, опускают, сохраняя лишь перекрещивающиеся линии и символы заместителей. Чтобы помнить о пространственном расположении заместителей, часто сохраняют в проекционных формулах прерывистую вертикальную линию (верхний и нижний заместитель удалены за плоскость чертежа), однако часто этого не делают. Ниже приведены примеры различных способов изображения одной и той же структуры с определенной конфигурацией (рис. 2)
|
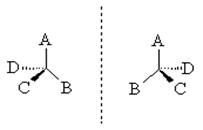
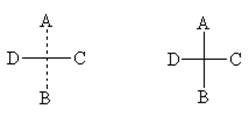
Рис. 2
Приведем несколько примеров проекционных формул Фишера (рис.3)
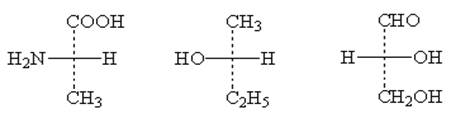
(+)-(L)-аланин(-)-2-бутанол (+)-(D)-глицериновый альдегид
Рис. 3
Поскольку на тетраэдр можно смотреть с разных сторон, то каждый стереоизомер может быть изображен двенадцатью (!) различными проекционными формулами. Чтобы стандартизировать проекционные формулы, введены определенные правила их написания. Так, главную (номенклатурную) функцию, если она находится в конце цепи, принято ставить наверху, главную цепь изображать вертикально.
Для того чтобы сопоставлять "нестандартно" написанные проекционные формулы, надо знать следующие правила преобразования проекционных формул.
1. Формулу нельзя выводить из плоскости чертежа и нельзя поворачивать на 90о, хотя можно вращать в плоскости чертежа на 180о, не меняя их стереохимического смысла (рис. 4)

Рис. 4
2. Две (или любое четное число) перестановки заместителей у одного асимметрического атома не меняют стереохимического смысла формулы (рис.5)

Рис. 5
3. Одна (или любое нечетное число) перестановка заместителей у асимметрического центра приводит к формуле оптического антипода (рис.6)
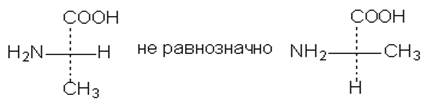
Рис. 6
4. Поворот в плоскости чертежа на 900 превращает формулу в антиподную, если только при этом одновременно не изменить условие расположения заместителей относительно плоскости чертежа, т.е. считать, что теперь боковые заместители находятся за плоскостью чертежа, а верхний и нижний - перед ней. Если пользоваться формулой с пунктиром, то изменившаяся ориентация пунктира прямо напомнит об этом (рис.7)

Рис. 7
5. Вместо перестановок проекционные формулы можно преобразовывать путем вращения любых трех заместителей по часовой стрелке или против нее (рис.8); четвертый заместитель при этом положения не меняет (такая операция эквивалентна двум перестановкам):

Рис. 8
Проекции Фишера нельзя применять к молекулам, хиральность которых связана не с хиральным центром, а с другими элементами (осью, плоскостью). В этих случаях необходимы трехмерные изображения.
1.2 D,L- Номенклатура Фишера
Одну проблему мы обсудили – как изобразить трехмерную структуру на плоскости. Выбор способа диктуется исключительно удобством представления и восприятия стреоинформации. Следующая проблема связана с составлением названия для каждого индивидуального стереоизомера. В названии должна быть отражена информация о конфигурации стереогенного центра. Исторически первой номенклатурой для оптических изомеров была D,L- номенклатура, предложенная Фишером. До 1960–х годов боле привычным было обозначать конфигурацию хиральных центров на основании плоских проекций (Фишера), а не на основании трехмерных 3D – формул, при этом использовались дескрипторы D и L. В настоящее время D,L –система используется ограниченно – главным образом для таких природных соединений, как аминокислоты, оксикислоты и углеводы. Примеры, иллюстрирующие ее применение, показаны на рис.10.
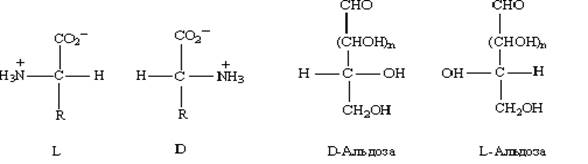
Рис. 10
Для α – аминокислот конфигурация обозначается символом L, если в проекционной формуле Фишера амино –(или аммонийная) группа расположена слева,; символ D используется для противоположного энантиомера. Для сахаров обозначение конфигурации основано на ориентации ОН – группы с высшим номером (самой удаленной от карбонильного конца). Если ОН – группа направлена вправо, то это – конфигурация D; если ОН слева – конфигурация L.
Система Фишера в свое время позволила создать логичную и непротиворечивую стереохимическую систематику большого числа природных соединений, ведущих свое происхождение от аминокислот и сахаров. Однако ограничения Фишеровской системы, а также тот факт, что в 1951 г. появился рентгеноструктурный метод определения истинного расположения групп вокруг хирального центра, привели к созданию в 1966 г. новой, более строгой и непротиворечивой системы описания стереоизомеров, известной под названием R,S - номенклатуры Кана—Ингольда—Прелога (КИП). В системе КИП к обычному химическому названию прибавляются специальные дескрипторы R или S (в тексте выделяются курсивом), строго и однозначно определяющие абсолютную конфигурацию.
1.3 НоменклатураКана—Ингольда—Прелога
Для того,чтобы определить дескриптор R или S для данного хирального центра, используется так называемое правило хиральности. Рассмотрим четыре заместителя, связанные с хиральным центром. Их следует расположить в единообразной последовательности стереохимического старшинства; для удобства давайте обозначим эти заместители символами А, В, D и Е и условимся считать, что в общей последовательности старшинства (иначе говоря, по приоритету) А старше В, В старше D, D старше E(A>B>D>E). Правило хиральности КИП требует, чтобы модель рассматривалась со стороны, противоположной той, которую занимает заместитель Е с низшим приоритетом или стереохимически младший заместитель (рис.11). Тогда остальные три заместителя образуют нечто вроде треножника, ножки которого направлены на зрителя.
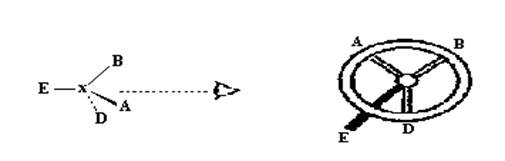
Рис. 11
Если падение старшинства заместителей в ряду A>B>D осуществляется по часовой стрелке (как на рис 11 ), то центру присваивается конфигурационный дескриптор R (от латинского слова rectus — правый). При другом расположении, когда стереохимическое старшинство заместителей падает против часовой стрелки, центру присваивается конфигурационный дескриптор S (от латинского sinister — левый).
При изображении соединений с помощью Фишеровских проекций можно легко определить конфигурацию без построения пространственных моделей. Формулу надо записать так, чтобы младший заместитель находился внизу или вверху, так как по правилам представления проекций Фишера вертикальные связи направлены от наблюдателя (рис.12). Если при этом остальные заместители в порядке уменьшения старшинства располагаются по часовой стрелке, соединение относят к (R)-ряду, а если против часовой стрелки, то к (S)-ряду, например:
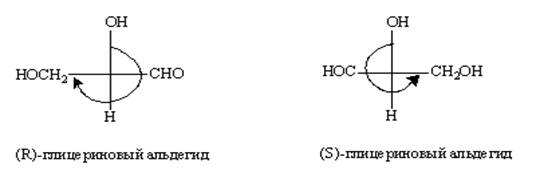
Рис. 12
Если младшая группа не находится на вертикальных связях, то следует поменять ее местами с нижней группой, но следует помнить, что при этом происходит обращение конфигурации. Можно сделать две любые перестановки – при этом конфигурация не изменится.
Таким образом, определяющим является стереохимическое старшинство. Обсудим теперь правила последовательности старшинства, т.е. правила, по которым группы А,В,D и Е располагают в порядке приоритета.
1. Предпочтение по старшинству отдается атомам с большим атомным номером. Если номера одинаковы (в случае изотопов), то более старшим становится атом с наибольшей атомной массой (например, D>Н). Самый младший «заместитель» - неподеленная электронная пара (например, у азота). Таким образом, старшинство возрастает в ряду: неподеленная пара <H<D<T<Li<B<C<N<O<F <Si<P<S<Cl<Br<I
Рассмотрим простой пример: в бромхлорфторметане CHBrCIF (рис.13) имеется один стереогенный центр, и два энантиомера можно различить следующим образом. Сначала ранжируют заместители по их стереохимическому старшинству: чем больше атомный номер, тем старше заместитель. Поэтому в данном примере Br > С1 > F > Н, где «>» обозначает «более предпочтителен» (или «старше»). Следующий шаг — рассмотреть молекулу со стороны, противоположной самому младшему заместителю, в данном случае водороду. Видно, что три остальных заместителя расположены в углах треугольника и направлены к наблюдателю. Если старшинство в этой тройке заместителей уменьшается по часовой стрелке, то этот энантиомер обозначают как R. При другом расположении, когда старшинство заместителей падает против часовой стрелки, энантиомер обозначают как S. Обозначения R и S пишут курсивом и помещают в скобках перед названием структуры. Таким образом, два рассмотренных энантиомера имеют названия (S)-бромхлорфторметан и (R)-бромхлорфторметан.

Рис. 13
2. Если с асимметрическим атомом непосредственно связаны два, три или все четыре одинаковых атома, старшинство устанавливается по атомам второго пояса, которые связаны уже не с хиральным центром, а с теми атомами, которые имели одинаковое старшинство.
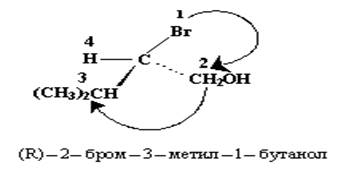
Рис. 14
Например, в молекуле 2-бром-3-метил-1-бутанола (рис.14) по первому поясу легко определяется самый старший и самый младший заместители – это бром и водород соответственно. Но по первому атому групп СН2ОН и СН(СН3)2 установить старшинство не удается, так как в обоих случаях это атом углерода. Для того чтобы определить, какая из групп старше, снова применяют правило последовательности, но теперь рассматривают атомы следующего пояса. Сравнивают два набора атомов (две тройки), записанных в порядке падения старшинства. Старшинство теперь определяют по первой точке, где обнаруживается различие. Группа СН2ОН – кислород, водород, водород С(ОНН) или в цифрах 6(811). Группа СН(СН3)2 – углерод, углерод, водород С(ССН) или 6(661). Первая точка различия подчеркнута: кислород старше углерода (по атомному номеру), поэтому группа СН2ОН старше СН(СН3)2. Теперь можно обозначить конфигурацию энантиомера, изображенного на рисунке 14 как (R).
Если и такая процедура не привела к построению однозначной иерархии, ее продолжают на все более возрастающих расстояниях от центрального атома, пока, наконец, не встретятся различия, и все четыре заместителя получат свое старшинство. При этом любое предпочтение, приобретаемое тем или иным заместителем на одной из стадий согласования старшинства, считается окончательным и на последующих стадиях переоценке не подлежит.
3. Если в молекуле встречаются точки разветвления, процедуру установления старшинства атомов следует продолжать вдоль молекулярной цепи наибольшего старшинства. Предположим, следует определить последовательность старшинства двух заместителей, изображенных на рис.15. Очевидно, что решение не будет достигнуто ни в первом (С), ни во втором (С,С,Н) ни в третьем (С,Н,F,С,Н,Br) слоях. В этом случае придется переходить в четвертый слой, но сделать это следует по пути, преимущество которого установлено в третьем слое (Br >F). Следовательно, решение о приоритете заместителя В над заместителем А делается на основании того, что в четвертом слое Br >CI для той ветви, переход на которую диктуется старшинством в третьем слое, а не на основании того, что наибольшим атомным номером в четвертом слое обладает атом I (который находится на менее предпочтительной и поэтому не исследуемой ветви).
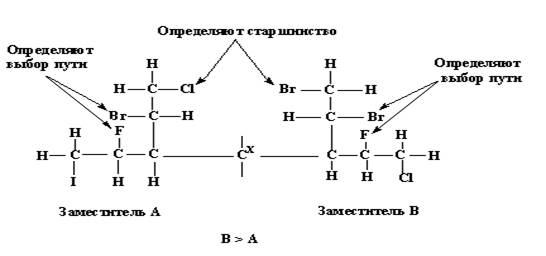
Рис. 15
4. Кратные связи представляются как сумма соответствующих простых связей. В соответствии с этим правилом каждому атому, связанному кратной связью, ставится в соответствие дополнительный «фантомный» атом (или атомы) того же сорта, расположенный на другом конце кратной связи. Комплементарные (дополнительные или фантомные) атомы заключаются в скобки, и считается, что они не несут никаких заместителей в следующем слое.В качестве примера рассмотрим представления следующих групп (рис.16).
| |
| |
| |
| |
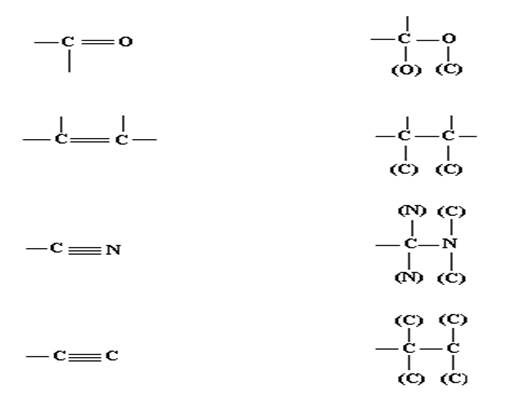
| |
5. Искусственное увеличение числа заместителей требуется и тогда, когда заместитель (лиганд) является бидентатным (или три-, или тетрадентатным),а также когда заместитель содержит циклический или бициклический фрагмент. В таких случаях каждая ветвь циклической структуры рассекается после точки ветвления [где она раздваивается сама по себе], и атом, являющий точкой ветвления, помещается (в скобках) в конце цепи, возникшей в результате рассечения. На рис.17 на примере производного тетрагидрофурана (ТГФ) рассмотрен случай бидентатного (циклического) заместителя. Две ветви пятичленного кольца (по отдельности) рассекаются по связям с хиральным атомом, который после этого добавляется к концу каждой из двух вновь образованных цепей. Видно, что в результате рассечения А получается гипотетический заместитель –СН2ОСН2СН2-(С), который оказывается старше, чем реальный ациклический заместитель -СН2ОСН2СН3 по причине преимущества фантомного (С) на конце первого заместителя. Напротив, образованный в результате рассечения В гипотетический лиганд –СН2СН2ОСН2–(С) по старшинству оказывается ниже реального заместителя –СН2СН2ОСН2СН3, поскольку у последнего к концевому углероду присоединены три атома водорода, а у первого в этом слое нет ни одного. Следовательно, с учетом установленного порядка старшинства заместителей, конфигурационным символом для данного энантиомера оказывается S.
|
|
|
|
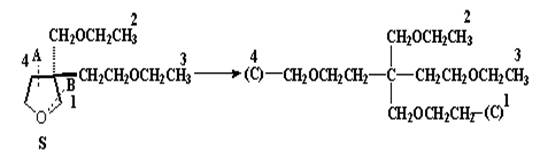
Рис.17
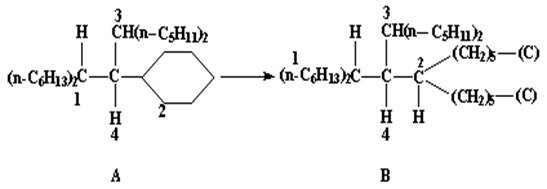
Рис. 18
Сходный случай рассечения циклического заместителя поясняется на примере соединения на рис. 18 , где структура В иллюстрирует трактовку циклогексильного кольца (в структуре А). В этом случае правильной последовательностью старшинства является ди-н-гесилметил > циклогексил > ди-н-пентилметил > Н.
Теперь мы достаточно подготовлены, чтобы рассмотреть такой заместитель, как фенил (рис.19 структура А). Схему раскрытия каждой кратной связи мы обсудили выше. Поскольку (в любой структуре Кекуле) каждый из шести атомов углерода связан двойной связью с другим атомом углерода, то (в системе КИП) каждый углеродный атом кольца несет в качестве «заместителя» дополнительный углерод. Дополненное таким образом кольцо (рис.19, структура В) затем раскрывается по правилам для циклических систем. В результате рассечение описывается схемой, изображенной на рис.19, структура С.
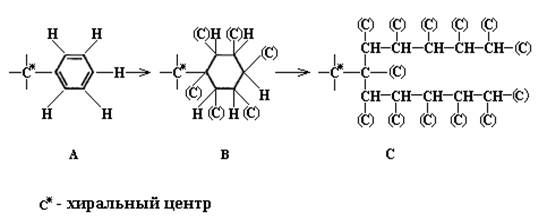
Рис. 19
6. Теперь мы рассмотрим хиральные соединения, в которых различия между заместителями носят не материальный или конституционный характер, а сводятся к различиям в конфигурации. Соединения, содержащие более одного хирального центра, будут рассмотрены ниже (см. раздел 1.4) Здесь же мы коснемся заместителей, которые отличаются цис– транс – изомерией (олефинового типа). Согласно Прелогу и Хельмхену, олефиновый лиганд, в котором старший заместитель, расположен по ту же сторону от двойной связи олефина, что и хиральный центр, обладает преимуществом над лигандом, в котором старший заместитель оказывается в транс–положении к хиральному центру. Это положение не имеет отношения ни к классической цис–транс-, ни к E–Z–номенклатуре для конфигурации двойной связи. Примеры изображены на рис.20.
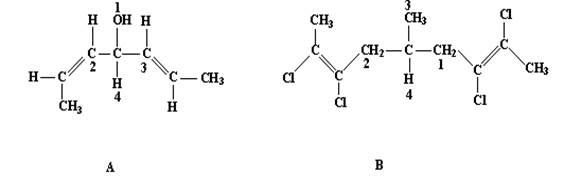
Рис. 20
1.4
| |
Если в молекуле имеются два хиральных центра, то, поскольку каждый центр может иметь (R)- или (S)-конфигурацию, возможно существование четырех изомеров — RR, SS, RS и SR:

Рис. 21
Поскольку молекула имеет только одно зеркальное отображение, энантиомером соединения (RR) может быть только изомер (SS). Аналогично другую пару энантиомеров образуют изомеры (RS) и (SR). Если меняется конфигурация лишь одного асимметрического центра, то такие изомеры называются диастереомерами. Диастереомеры — это стереоизомеры, не являющиеся энантиомерами. Так, диастереомерны пары (RR)/(RS), (RR)/(SR), (SS)/(RS) и (SS)/(SR). Хотя в общем случае при сочетании двух хиральных центров образуются четыре изомера, сочетание центров одинакового химического строения дает лишь три изомера: (RR) и (SS), являющиеся энантиомерами, и (RS), находящийся в диастереомерном отношении к обоим энантиомерам (RR) и (SS). Типичным примером является винная кислота (рис.22), которая имеет только три изомера: пару энантиомеров и мезо-форму.
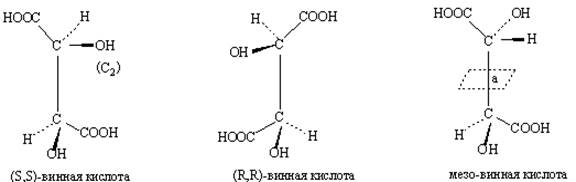
Рис. 22
 мезо-Винная кислота является (R,S)-изомером, который оптически неактивен, поскольку объединение двух зеркально-симметричных фрагментов приводит к появлению плоскости симметрии (а). мезо-Винная кислота представляет собой пример ахирального соединения мезо-конфигурации, которое построено из равного числа одинаковых по структуре, но разных по абсолютной конфигурации хиральных элементов.
мезо-Винная кислота является (R,S)-изомером, который оптически неактивен, поскольку объединение двух зеркально-симметричных фрагментов приводит к появлению плоскости симметрии (а). мезо-Винная кислота представляет собой пример ахирального соединения мезо-конфигурации, которое построено из равного числа одинаковых по структуре, но разных по абсолютной конфигурации хиральных элементов.
Если в молекуле имеется п хиральных центров, максимальное число стереоизомеров можно рассчитать по формуле 2n ; правда, иногда число изомеров будет меньше благодаря наличию мезо-форм.
Для наименований стереоизомеров молекул, содержащих два асимметрических атома углерода, два заместителя при каждом из которых одинаковы, а третьи отличаются, часто используют префиксы эритро- и трео- от названий сахаров эритрозы и треозы. Эти префиксы характеризуют систему в целом, а не каждый хиральный центр в отдельности. При изображении таких соединений с помощью проекций Фишера в паре эритро- изомеров одинаковые группы располагаются с одной стороны, и если бы разные группы (С1 и Вг в приведенном ниже примере) были одинаковы, получилась бы мезо-форма. В паре трео-изомеров одинаковые группы располагаются с разных сторон, и если бы разные группы были одинаковы, новая пара осталась бы энантиомерной парой.
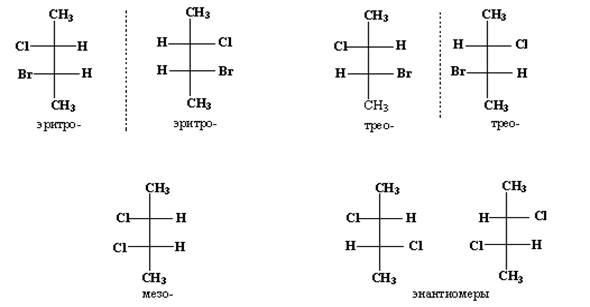
Рис. 23
Все рассмотренныевыше примерысоединений имеют центр хиральности. Таким центром является асимметрический атом углерода. Однако, центром хиральности могут быть и другие атомы (кремния, фосфора, серы), как, например, в метилнафтилфенилсилане, о-анизилметилфенилфосфине, метил-п-толилсульфоксиде (рис. 24)

Рис. 24
|
из
5.00
|
Обсуждение в статье: Способы изображения оптических изомеров |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

