 |
Главная |
Метод водного баланса в гидрологии. Универсальное уравнение водного баланса
|
из
5.00
|
Количество воды на земном шаре
1390 млн. кубических км. – в мире свободной воды
96,4 % - свободной воды в мировом океане
1,9 % -ледники, постоянный снежный покров
1,7 % - подземные воды
2,6 % - пресная вода (Большая ее часть законсервирована в виде ледников в малонаселенных и далеких участках нашей планеты.)
Понятие гидросферы трактуется несколькими формулировками:
Гидросфера – это прерывистая, водная оболочка земного шара, расположенная на поверхности земной коры и в её толщи, представляющая совокупность морей, океанов и водных объектов суши, включая снежный покров и ледники.
Гидросфера – под этим понятием подразумевают воды, которые находятся между атмосферой и литосферой.
Гидросфера – представляет собой непрерывную водную оболочку земли, включая все природные воды Земли, участвующие в глобальном круговороте веществ.
Гидрографическая сеть — совокупность рек и других постоянно и временно действующих водотоков, а также озёр, болот и водохранилищ на какой-либо территории.
Русловая сеть – часть гидрографической сети представленная водотоками. Речная сеть – состоящая только из крупных водоток.
Вопрос 2
Гидрологические характеристики и гидрологическое состояние водного объекта. Гидрологический режим и гидрологические процессы.
Гидрологические характеристики- параметры, характеризующие водную среду и ее пограничные слои:
- Характеристики водного режима.
Уровень воды (Н, либо z) измеряется в метрах абсолютных, либо в см. над нулем поста.
Скорость течения ( V либо U) в м/с
Расход воды (Q) м. в кубе/с
Уклон водной поверхности (I) безразмерный
- Характеристики теплового режима
Температура воды, снега, льда (Т) в т. Цельсия С, К
- Характеристики ледового режима
-сроки наступления и окончания ледовых фаз режима ( замерзание, ледостав, таяние вскрытие)
Толщина ледового покрова (h) в см., м.
- Характеристики режимов наносов
– содержание в воде взвешенных наносов или мутность воды кг/м кубический, расход наносов(R) кг/с, распределение наносов по фракции, крупность (Геометрическая(Д) в мм. Гидравлическая (W) в мм/с)
- Морфометрические характеристики
Длина (L) в м., км
Ширина (В) в м., км
Глубина (h) в м.
- Гидрохимические характеристики
Минерализация (М) мг/л
Соленость (S) в ˳/˳˳
Концентрация (C) мг/л
- Гидрофизические характеристики
Плотность (ρ) кг/м кубический
Вязкость
- Гидробиологические характеристики
состав и численность водных организмов.
Гидрологическое состояние водного объекта-совокупность гидрологических характеристик водного объекта в данном месте и в данный момент времени.
Совокупность закономерно повторяющихся изменений гидрологического состава водного объекта во времени и пространстве это его гидрологический режим
Изменчивости: Вековая, многолетняя, внутригодовая или сезонная, кратковременная, суточная (внутрисуточная).
Гидрологические процессы – совокупность физических, химических и биологических процессов, которые определяют закономерности формирования гидрологического состояния и режима водного объекта. Гидрологический процесс- это процесс формирования гидрологического режима. При гидрологическом процессе вода вступает во взаимодействие с природной средой.
Вопрос 3
Вода как вещество, её молекулярная структура и изотопный состав
Вода – одно из самых распространённых веществ в природе (гидросфера занимает 71 % поверхности Земли).
Воде принадлежит важнейшая роль в геологии, истории планеты. Без воды невозможно существование живых организмов.
Нет на Земле вещества более важного для нас, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, сколько в её свойствах. Почти 60% поверхности нашей планеты занято океанами и морями. Твёрдой водой – снегом и льдом – покрыто 20% суши. Почти 70% пресных вод заключено в ледниковых покровах полярных стран и в горных ледниках, 30% - в водоносных слоях под землёй, а в руслах всех рек содержатся одновременно всего лишь 0,006% пресных вод. Молекулы воды обнаружены в межзвёздном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников.
Химически чистая вода не имеет ни цвета, ни запаха, ни вкуса
1.(H2O)1 – моногидроль (рыхлая)
2. (H2O)2 – дигидроль (самая плотная)
3. (H2O)3 – тригидроль
Лед легче воды (рыхлая компановка)
Изотопный состав
Молекула воды состоит из двух атомов водорода и одного атома кислорода.
Водород имеет два стабильных изотопа — протий (Н) — 1H и дейтерий (D) — 2H.
У кислорода три устойчивых изотопа: 16O, 17O и 18O
Вода состоит из самых распространенных атомов в нашем мире – из водорода и кислорода, причем самым распространенным атомом во Вселенной является водород.
Существуют девять устойчивых изотопных разновидностей воды. Содержание их в пресной воде в среднем следующее: Н2 16О – 99,73%(обычная, нормальная вода), Н2 18О – 0,2%, Н2 17О – 0,04%, 1H2Н16О – 0,03%.
D2O<T2O, где D2 и T2 - тяжёлые изотопы
Молекула H2 16O является самой лёгкой из совокупности всех изотопологов воды. Именно воду 1H216O следует считать классической или лёгкой водой. Лёгкая вода как моноизотопная композиция 1H216O является предельным случаем изотопной чистоты. В естественных условиях такой чистой лёгкой воды не существует.
Строение молекулы.
Как известно, свойства химических соединений зависят от того, из каких элементов состоят их молекулы, и изменяются закономерно. Воду можно рассматривать как оксид водорода или как гидрид кислорода. Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О – Н (рисунок) . Но поскольку оба водородных атома расположены по одну сторону от кислородного, электрические заряды в ней рассредоточиваются. Молекула воды полярна, что является причиной особого взаимодействия между разными её молекулами. Атомы водорода в молекуле воды, имея частичный положительный заряд, взаимодействуют с электронами атомов кислорода соседних молекул.Такая химическая связь называется в о д о р о д н о й. Она обьединяет молекулы воды в своеобразные полимеры пространственного строения. Вода – единственное вещество на Земле, которое существует в природе во всех трёх агрегатных состояниях – жидком, твёрдом и газообразном. Максимальная плотность при 4 градусах.
|

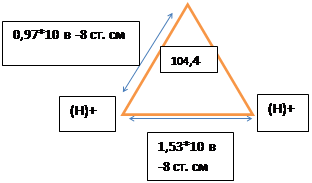
4.Химические свойства воды. Классификация природных вод по минерализации. Различие солевого состава речных и морских вод. Понятие о качестве воды.Вода – слабый электролит, диссоциирует по уравнению H2O = H+ ОН-. Уравнение характеризует ионное равновесие воды. Водородный показатель рН , который представляет собой логарифм концентрации водородных ионов, взятый с обратным знаком. Природная вода слабый растворитель. Минерализация – суммарное содержание в воде растворенных неорганических веществ (мг\л). Соленость воды – содержание растворенных в воде веществ выраженных в г/кг или в промилле. Воды: пресные – менее 1 промилле, солоноватые 1-25, соленые 25-50, высокосоленые(рассолы) свыше 50. 24.7 промилле соленость при которой температура наибольшей плотности и температура замерзания совпадают. Главные ионы солей (макрокомпоненты): НСО3, SO4, Cl, Ca, Mg, Na и К. По аниону природные воды делятся на три класса: гидрокарбонатные, сульфатные и хлоридные. По катиону на кальциевые, магниевые, и натриевые. Речные воды – гидрокарбонатный класс и кальциевая группа. Подземные - сульфатный класс и магниевая группа. Воды океанов и морей – хлоридный класс и натриевая группа. Жесткость – сумма кальция и магния. В воде растворяются газы – кислород, азот, диоксид углерода, сероводород. Биогенные вещества азот, фосфор, кремний. Органические вещества – углеводы, белки, эфиры. Микроэлементы: бром, йод, фтор, литий, барий, ферум, никель, цинк, кобальт, купрум, плюмбум и др. Загрязняющие вещ-а: нефтепродукты, радиоактивные в-ва, пестициды и т.д. Качество воды – характеристика состава и свойств воды определяющее её пригодность для конкретного вида водопользования. Характеризуется ее физическими, химическими и бактериологическими свойствами. К физическим свойствам относятся ее температура, цветность, мутность, привкус и запах. Химические свойства воды характеризуются следующими показателями: активной реакцией, жесткостью, окисляемостью, содержанием растворенных солей.
5.Физические «аномалии» воды и их гидрологическое значение. И первое, самое поразительное, свойство воды заключается в том, что вода принадлежит к единственному веществу на нашей планете, которое в обычных условиях температуры и давления может находиться в трех фазах, или трех агрегатных состояниях: в твердом (лед), жидком и газообразном (невидимый глазу пар). Аномалия плотности. Во-первых, после таяния льда плотность увеличивается, проходит через максимум при 4 оС и только затем уменьшается с ростом температуры. Вторая аномалия плотности состоит в том, что плотность воды больше плотности льда (благодаря этому лед плавает на поверхности воды, вода в реках зимой не вымерзает до дна и т.д.). Обычно же при плавлении плотность жидкости оказывается меньше, чем у кристалла. А плотность воды превышает плотность льда сразу на 10%! То есть скачок плотности при плавлении льда аномален не только по знаку, но и по величине. В последнее время много внимания уделяется изучению свойств переохлажденной воды, то есть остающейся в жидком состоянии ниже точки замерзания 0 оС. (Переохладить воду можно либо в тонких капиллярах, либо - еще лучше - в виде эмульсии: маленьких капелек в неполярной среде - "масле"). Что же происходит с аномалией плотности при переохлаждении воды? Она ведет себя странно. С одной стороны, плотность воды сильно уменьшается по мере переохлаждения (то есть первая аномалия усиливается), но, с другой стороны, она приближается к плотности льда при понижении температуры (то есть вторая аномалия ослабевает). Вот еще пример аномалии воды: необычное температурное поведение ее сжимаемости, то есть степени уменьшения объема при увеличении давления . Обычно сжимаемость жидкости растет с температурой: при высоких температурах жидкости более рыхлы (имеют меньшую плотность) и их легче сжать. Вода обнаруживает такое нормальное поведение только при высоких температурах. При низких же сжимаемость ведет себя противоположным образом, в результате чего в ее температурном поведении появляется минимум при 45 оС. Среди необычных свойств воды трудно обойти вниманием еще одно - ее исключительно высокое поверхностное натяжение 0,073 Н/м (при 20o С). Из всех жидкостей более высокое поверхностное натяжение имеет только ртуть. Оно проявляется в том, что вода постоянно стремится стянуть, сократить свою поверхность, хотя она всегда принимает форму емкости, в которой находится в данный момент. Вода лишь кажется бесформенной, растекаясь по любой поверхности. Сила поверхностного натяжения заставляет молекулы ее наружного слоя сцепляться, создавая упругую внешнюю пленку. Что же это за необычный процесс, происходящий в воде и делающий ее непохожей на другие жидкости? Самая большая теплоёмкость (в 3100 раз больше, чем у воздуха; в 4 раза больше, чем у горных пород). Величина теплоемкости, как известно, показывает, сколько нужно затратить тепла, чтобы поднять температуру вещества на один градус. Для подавляющего числа веществ теплоемкость жидкости после плавления кристалла увеличивается незначительно - никак не более 10%. Другое дело - вода. При плавлении льда теплоемкость скачет от 9 до 18 кал/моль " град, то есть в два раза! Такого огромного скачка теплоемкости при плавлении не наблюдается ни у одного другого вещества: здесь вода абсолютный рекордсмен.Во льду энергия, подводимая для нагревания, тратится в основном на увеличение тепловой скорости молекул. Скачок теплоемкости после плавления означает, что в воде открываются какие-то новые процессы (и очень энергоемкие), на которые тратится, подводимое тепло и которые обусловливают появление избыточной теплоемкости. Такая избыточная теплоемкость и, следовательно, упомянутые энергоемкие процессы существуют во всем диапазоне температур, при которых вода находится в жидком состоянии. Она исчезает только в паре, то есть эта аномалия является свойством именно жидкого состояния воды. Теплоемкость воды аномальна не только по своему значению. Удельная теплоемкость разная при различных температурах, причем характер температурного изменения удельной теплоемкости своеобразен: она снижается по мере увеличения температуры в интервале от 0 до 37o С, а при дальнейшем увеличении температуры - возрастает. Минимальное значение удельной теплоемкости воды обнаружено при температуре 36,79o С! Нормальная температура почти всех теплокровных живых организмов также находится вблизи этой точки. При сильном переохлаждении теплоемкость сильно возрастает, то есть аномальный вклад в нее еще больше увеличивается.
6. Агрегатные состояния воды и их фазовые переходы. Вода - единственное вещество на Земле, встречающееся во всех трех состояниях: в виде газа, жидкости и льда. Состояние воды, наиболее привычное для нас - это жидкость, но оно возможно лишь при температуре от 0 до 100 градусов Цельсия. При температуре в 100 градусов по Цельсию (точка кипения), вода переходит из жидкого состояния в газообразное. Это происходит по причине того, что при нагревании (т.е. поступлении энергии), молекулы воды движутся все быстрее и быстрее, стремятся к рассеиванию. При еще большем повышении температуры, молекулы разрывают силы, связывающие их друг с другом и "испаряются" в воздух. Вода меняет свое агрегатное состояние и переходит в пар, т.е. газ. Обратное происходит при снижении температуры до точки замерзания (0 градусов Цельсия). Тогда, молекулы движутся в се медленнее и медленнее, пока наконец не соединяются при замерзании воды в лед. Однако, смена агрегатного состояния воды зависит от давления. На больших высотах, при пониженном давлении точка кипения воды (и других жидкостей) будет ниже, чем на уровне моря. Следовательно, на равнинной территории, например, яйцо будет вариться дольше, чем на горе Эверест, где давление ниже. Переходы между этими состояниями, происходящие при определенных температуре и давлении, называются фазовыми переходами.

(7)Плотность воды и ее зависимость от температуры,солености и давления. Общеизвестно, что все вещества при нагревании увеличивают свой объем и уменьшают плотность. У воды наблюдается то же самое, за исключением интервала от 0 до 4° С, когда с возрастанием температуры объем воды не увеличивается, а, наоборот, сокращается. Максимальная плотность отмечается при 4° С (рис. 4). Таким образом, для воды зависимость между объемом и температурой не однозначна (как в нормальных условиях для других веществ), а двузначна. Чем выше соленость тем выше плотность. Давление влияет незначительно. На глубинах 11 км плотность воды будет выше на 48 кг\м3.

Ро равно отношеню массы к объёму(кг на метр кубический).
Ро равно f(р,Т,М(S),мелкие взвеси)
Лед легче воды.
8. Тепловые свойства воды. Зависимость температуры замерзания и темп. Максимальная плотность от солености воды. Тепловая емкость воды, т.е. количество тепла, необходимое для увеличения температуры воды на один градус, выше, чем у большинства других жидкостей. Тепловая проводимость воды, т.е. способность передавать тепло, в четыре раза выше, чем у других жидкостей.. Тепловая проводимость льда и снега, напротив, низка. Подобно другим жидкостям, вода сокращается в объеме при охлаждении, но не ниже 4oС. При дальнейшем понижении температуры, в отличие от всех других известных жидкостей, она вдруг начинает расширяться и, когда она замерзает, т.е. оказывается в твердом состоянии, она расширяется еще больше. В результате "твердая вода" легче "жидкой воды". По законам физики твердая вода, т.е. лед, должен быть тяжелее жидкой воды и тонуть, однако он плавает на поверхности воды.
Когда лед тает и вода испаряется, тепло поглощается из окружающей среды. Когда этот процесс протекает в обратном направлении (т.е. вода замерзает или пар осаждается), высвобождается тепло. Жидкости, как правило, замерзают снизу вверх, вода же - сверху вниз. Это первое необычное свойство, благодаря которому вода находится на поверхности земли, а лед плавает по воде. Если бы не это свойство, большая часть нашей планеты была закована во льды, и жизнь в ее морях, озерах, прудах и реках была бы невозможна.
Удельная теплота плавления(замерзания) 33310 в третьей степени Дж на кг.
Удельная теплота парообразования 2.26*10 в 6 степени Дж на кг.
Удельная терлоемкость 4/90 Дж(кг*градус)
Теплопроводность воды 0.6 Вт(л*град)-вода
2.24 Вт(л*град)-лед
1.8 Вт(л*град)-снег
(9)Использование фундаментальных законов физики при изучении водных объектов. Фундаментальные законы физики – сохранения вещества, сохранения энергии и изменения импульса (количества движения) Закон сохранения массы – неизменность массы в замкнутой системе.dm = M+ -M-. Закон сохранения энергии — основной закон природы, заключающийся в том, что энергия замкнутой системы сохраняется во времени. Другими словами, энергия не может возникнуть из ничего и не может в никуда исчезнуть, она может только переходить из одной формы в другую.Е=Епот+Екин+Едис. Едис – диссипация энергии ( переход части механич энергии в тепловую в результ трения).Зако́н сохране́ния и́мпульса (Зако́н сохране́ния количества движения) утверждает, что сумма импульсов всех тел (или частиц) замкнутой системы есть величина постоянная. Применительно к водным объектам (открытым системам) он переходи в закон изменения количества импульса, который означает что изменение количества импульса открытой системы равно сумме всех внешних сил, действующих на эту систему.
Вопрос 10
Метод водного баланса в гидрологии. Универсальное уравнение водного баланса.
Водный баланс – это соотношение между приходом и расходом воды. Физической основой водного баланса является закон сохранения вещества, а его энергетической основой – солнечная радиация и сила тяжести.
озеро
 |
х – осадки
у1 – поверхностный сток
w1 – подземный приток
x+y1+w1=z+y2+w2±∆u, ∆t
z – испарение
у2 – поверхностный отток
w2 – подземный отток
∆u – изменение количества воды в пределах одного водного объекта
Метод водного баланса заключается в:
- составление уравнения водного баланса за промежуток времени (∆t);
- в анализе вклада различных составляющих;
- определение неизвестных составляющих по известным.
х=z+у, ∆t– это самое общее уравнение водного баланса для всей Земли.
Вопрос 11
|
из
5.00
|
Обсуждение в статье: Метод водного баланса в гидрологии. Универсальное уравнение водного баланса |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

