 |
Главная |
Активности в идеальных растворах
|
из
5.00
|
Предположим, что в достаточно разбавленных растворах молекулы растворенных веществ так разобщены между собой растворителем, что их взаимодействием можно пренебречь. К таким растворам применимы законы бесконечно разбавленных растворов и идеальных газов.
В условиях идеального газа при постоянной температуре изменения свободной энтальпии отдельного газового компонента i зависят от изменения только его парциального давления:
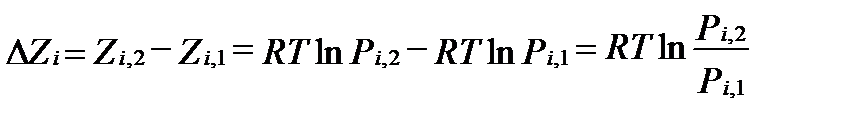 . (II‑51)
. (II‑51)
Это уравнение позволяет определять изменение величины свободной энтальпии отдельного компонента, как функцию изменения его парциального давления и температуры. Если принять стандартную свободную энтальпиюкомпонента  за некоторое условное начало координат, то можно определить его относительную свободную энтальпию в любых нестандартных условиях. Если в стандартном состоянии
за некоторое условное начало координат, то можно определить его относительную свободную энтальпию в любых нестандартных условиях. Если в стандартном состоянии 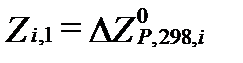 и Pi1=
и Pi1= 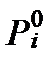 =1 атм, то отклонение свободной энтальпии от ее значения в стандартных условиях равно:
=1 атм, то отклонение свободной энтальпии от ее значения в стандартных условиях равно:
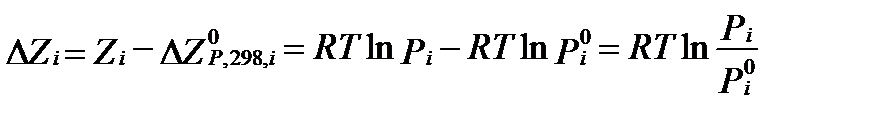 , (II‑52)
, (II‑52)
где - свободная энтальпия, а P0i –парциальное давление или давление насыщенного пара компонента i в стандартных условиях. Тогда сама свободная энтальпия в нестандартных условиях будет равна:
 . (II‑53)
. (II‑53)
Свободная энтальпия согласно этому уравнению зависит от температуры и соотношения 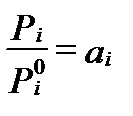 . Соотношение парциальных давлений компонента i в растворе и в его стандартном состоянии называется относительнойтермодинамической концентрацией (thermodynamic concentration)илипросто относительной активностью (relative activity), а чаще просто активностью . Тогда свободная энтальпия компонента i в растворе равна
. Соотношение парциальных давлений компонента i в растворе и в его стандартном состоянии называется относительнойтермодинамической концентрацией (thermodynamic concentration)илипросто относительной активностью (relative activity), а чаще просто активностью . Тогда свободная энтальпия компонента i в растворе равна
 (II‑54)
(II‑54)
а его химический потенциал можно определить по уравнению:
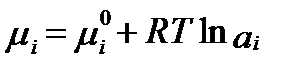 , (II‑55)
, (II‑55)
где  - химический потенциал компонента i в стандартном состоянии. Понятие относительной активности имеет большое значение в термодинамике растворов. Величина активности определяется уравнением:
- химический потенциал компонента i в стандартном состоянии. Понятие относительной активности имеет большое значение в термодинамике растворов. Величина активности определяется уравнением:
 (II‑56)
(II‑56)
и не имеет размерности. По своей сути она определяет, во сколько раз энергия компонента i в условиях раствора отличается от энергии его образования в стандартных условиях. Представления об термодинамической концентрации были введены американским учёным Гилбертом НьютономЛьюисом (1875-1946) в 1907 для разбавленных газовых растворов, а только потом распространены и на другие растворы. В связи с этим определение величин активности зависит от характера и состояния компонента. В этом отношении следует различать газовые, неполярные гидрофобные и полярные гидрофильные вещества.
Газовые компоненты стандартных условиях находятся только в газообразном состоянии и имеют давление насыщенного пара  =1 атм. Поэтому их безразмерная активность численно равна их парциальному давлению выраженному в атмосферах). Непосредственно в стандартных условиях, когда общее внешнее давлениие газовой смеси P =1 атм, их активность численно равна величине мольной доли, так как Pi=1∙Ci= Ci . В целом химический потенциал газовых компонентов в растворе определяется уравнением
=1 атм. Поэтому их безразмерная активность численно равна их парциальному давлению выраженному в атмосферах). Непосредственно в стандартных условиях, когда общее внешнее давлениие газовой смеси P =1 атм, их активность численно равна величине мольной доли, так как Pi=1∙Ci= Ci . В целом химический потенциал газовых компонентов в растворе определяется уравнением
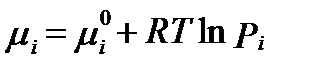 . (II‑57)
. (II‑57)
Неполярные гидрофобные вещества в стандартных условиях существуют в виде жидкости и пара, а их парциальное давление в этих условиях равно величинедавления насыщенного пара (saturation vapor pressure)  , которое заметно ниже 1 атм. Давление насыщенного параслужит мерой способности вещества переходить из твердого или жидкого состояния в парообразное. Чем больше давление пара, тем выше летучесть вещества.
, которое заметно ниже 1 атм. Давление насыщенного параслужит мерой способности вещества переходить из твердого или жидкого состояния в парообразное. Чем больше давление пара, тем выше летучесть вещества.
Француз Франсуа Мари Рауль (1830-1901) установил, что парциальное давление рассматриваемых веществ при относительно низких давлениях связано с их мольной долей в растворе уравнением. Согласно этому закону Рауля (Raoult law)имеем:
 , (II‑58)
, (II‑58)
где 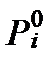 - давления насыщеного пара компонента i в стандартных условиях. Поэтому для неполярных гидрофобных веществ активностьчисленно равна их мольной доле в растворе:
- давления насыщеного пара компонента i в стандартных условиях. Поэтому для неполярных гидрофобных веществ активностьчисленно равна их мольной доле в растворе:
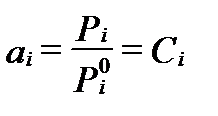 , (II‑59)
, (II‑59)
Это означает, что в разбавленных растворах их химический потенциал численно определяется по уравнению:
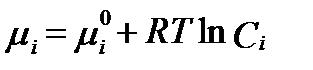 . (II‑60)
. (II‑60)
Полярные гидрофильные вещества представлены в растворе ионами, которые в чистом виде не существуют. Тем не менее, можно допустить, что активности этих ионов, как и у неполярных, пропорциональны их молной доле. Действительно, при разбавлении раствора в стандартных условиях растворитель H2O становится более чистым веществом, т.е. приближается к своему стандартному состоянию, когда величины его мольной доли и активности равны 1. Напротив, по мере того как их мольная доля Ci приближается к 0, соотношение ai/Ci приближается к 1. Отсюда следует, что в бесконечно разбавленных растворах электролитов допустимо равенство
 . (II‑61)
. (II‑61)
Однако концентрацию электролитов в водных растворах принято выражать не в мольных долях, а в моляльностях. Поэтому стандартный потенциал свободной энтальпии для расстворенных электролитов определяется при концентрации 1 моль на 1 кг растворителя, и их относительную активностьрассчитывают по уравнению:
 , (II‑62)
, (II‑62)
где 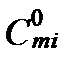 - стандартное значение моляльности равное 1 моль/кг. Активность ионов в разбавленных растворах является безразмерной величиной, численно равной их моляльности. Важно помнить, что эта активность всегда рассчитывается по соотношению концентраций, выраженных только в моляльностях. Концентрации ионов, выраженные в других величинах концентрации, необходимо пересчитывать в моляльности. Разница между молярными и моляльными концентрациями в разбавленных растворах не велика и ею часто пренебрегают. Концентрации, выраженные в мольных долях следует пересчитывать в моляльности. Величины мольной доли в разбавленных растворах приблизительно в 55,5 раз меньше эквивалентных величин моляльности. Для определения химического потенциала ионов обычно используется уравнение
- стандартное значение моляльности равное 1 моль/кг. Активность ионов в разбавленных растворах является безразмерной величиной, численно равной их моляльности. Важно помнить, что эта активность всегда рассчитывается по соотношению концентраций, выраженных только в моляльностях. Концентрации ионов, выраженные в других величинах концентрации, необходимо пересчитывать в моляльности. Разница между молярными и моляльными концентрациями в разбавленных растворах не велика и ею часто пренебрегают. Концентрации, выраженные в мольных долях следует пересчитывать в моляльности. Величины мольной доли в разбавленных растворах приблизительно в 55,5 раз меньше эквивалентных величин моляльности. Для определения химического потенциала ионов обычно используется уравнение
 , (II‑63)
, (II‑63)
где концентрация выражена в единицах моляльноси. Справочные данные по стандартным молярным величинам учитывают это, т.е. предполагают численную адекватность величин активности и концентрации, выраженной в единицах моляльности, в идеальных растворах.
|
из
5.00
|
Обсуждение в статье: Активности в идеальных растворах |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

