 |
Главная |
Биологическая роль глюконеогенеза
|
из
5.00
|
Этот процесс обеспечивает потребности в глюкозе в тех случаях, когда в организм поступает недостаточное количество углеводов. Глюкоза необходима для удовлетворения энергетических потребностей головного мозга, скелетных мышц, эритроцитов. В жировой ткани она является источником глицерина, входящего в состав жиров. В молочной железе глюкоза используется для образования лактозы и активно потребляется плодом в период развития.
Механизм глюконеогенеза используется для удаления из крови продуктов тканевого метаболизма, например, лактата, образующегося в мышцах и эритроцитах, и глицерина, непрерывно образующегося в жировой ткани.
· МЕТИЛМАЛОНАТНЫЙ ПУТЬ
Главным источником глюкозы у жвачных является пропионовая кислота, образующаяся в рубце жвачных животных в процессе сбраживания углеводов.
Превращение пропионовой кислоты в глюкозу в тканях осуществляется по метилмалонатному пути.
О АТФ, КоА-SH О
СН3 – СН2 – С// - ОН ¾¾¾¾¾¾¾® СН3 – СН2 – С// ~ S – KoA
пропионил-КоА- пропионил-КоА
синтетаза
-АМФ
-Н4Р2О7 ¾® 2Н3РО4
СООН СООН
АТФ, СО2 ½ ½
¾¾¾¾¾¾® Н – С – СН3 ¾¾¾¾¾¾® Н3С – С - Н ¾®
пропионил-КоА- ½ O рацемаза ½ О
карбоксилаза С// ~ S – KoA С// ~ S - КоА
АДФ, Н3РО4 D-метилмалонил-КоА L-метилмалонил-КоА
СООН
½
СН2
5-дезоксиаденозилкобаламин ½
¾¾¾¾¾¾¾¾¾¾¾¾® СН2
метилмалонил-КоА-мутаза ½ О
С //~ S – КоА
сукцинил-КоА
Сукцинил-КоА далее поступает в цикл трикарбоновых кислот, где через сукцинат, фумарат, L-малат превращается в оксалоацетат, который вовлекается в глюконеогенез.
· БИОСИНТЕЗ ГЛИКОГЕНА (ГЛИКОГЕНЕЗ)
Избыток глюкозы в крови используется для биосинтеза гликогена, который откладывается в депо, главным образом в печени и мышцах.
На 1-м этапе (рис. 9) происходит фосфорилирование глюкозы под действием гексокиназы(глюкокиназы) с образованием Г-6-Ф, который при участии фосфоглюкомутазы превращается в Г-1-Ф. Последний под действием УДФГ-пирофосфорилазы взаимодействует с УТФ (уридинтрифосфатом), в результате реакции образуются УДФ-глюкоза (активированная форма глюкозы) и пирофосфат. Гидролиз пирофосфата до 2-х молекул ортофосфата в присутствии фермента пирофосфатазы запускает синтез УДФ-глюкозы. На следующей стадии происходит перенос одного глюкозного остатка на затравку гликогена, полисахаридная цепь которой уже содержит более 4-х остатков глюкозы:
УДФ-глюкоза + (глюкоза)n ¾® УДФ + (глюкоза)n+1
Эта реакция катализируется гликогенсинтазой, которая образует между остатками глюкозы только a-1,4-гликозидные связи. Регенерация УТФ осуществляется в реакции: УДФ + АТФ ® УТФ + АДФ. Катализ реакции происходит при участии нуклеозиддифосфокиназы.
В образовании a-1,6-гликозидных связей молекулы гликогена участвует ветвящий фермент. Ветвление повышает растворимость гликогена, увеличивает скорость его синтеза и распада. Ветвящий фермент переносит блок, состоящий примерно из семи глюкозных остатков (он происходит из цепи длиной минимум в 11 остатков) ближе к внутренней части молекулы. Каждая новая точка ветвления должна быть удалена от предшествующей как минимум на 4 остатка.
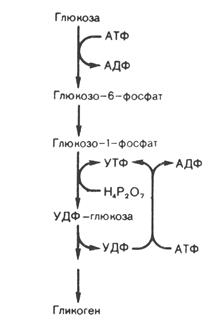
Рис. 9. Схема синтеза гликогена.
Гликоген печени используется как резерв глюкозы для организма животных в период между приемами корма, в то время как мышечный служит источником Г-6-Ф, являющегося источником АТФ для работы мышц.
· РЕГУЛЯЦИЯ ОБМЕНА УГЛЕВОДОВ
Важным показателем, характеризующим состояние углеводного обмена в организме животных, является концентрация глюкозы в крови, которая определяется соотношением между интенсивностью поступления ее в кровоток и выхода из крови (в норме в среднем 3,5 – 6,0 ммоль/л у большинства животных; у жвачных 2,2 – 3,3 ммоль/л; у птиц 7 – 8 ммоль/л).
Существует прямая связь между содержанием глюкозы в крови и функциональным состоянием центральной нервной системы. При уменьшении концентрации глюкозы в крови происходит возбуждение соответствующих нервных центров в гипоталамусе и продолговатом мозге. Нервные импульсы поступают в печень, где активируется гликогенфосфорилаза, катализирующая распад гликогена с образованием Г-1-Ф, который через Г-6-Ф превращается в глюкозу, поступающую в кровь. Таким образом восстанавливается уровень глюкозы в крови. Источники глюкозы для организма животных и пути ее использования указаны в таблице 3 и рис. 10.
Таблица 3. Поступление глюкозы в кровь и пути ее использования.
| Поступление | Использование |
| Из кишечника в процессе пищеварения. Из печени (глюконеогенез, мобилизация гликогена). | В мышцах (окисление или депонирование в виде гликогена). В ткани мозга (окисление). В жировой ткани (окисление и синтез липидов). В печени (синтез гликогена, липидов, аминокислот). Выделение с мочой (при гипергликемии выше 9,99 ммоль/л). |
Содержание глюкозы в крови регулируют многие гормоны.
Инсулинподжелудочной железы обеспечивает поступление глюкозы в клетки, активируя ее транспорт через клеточную мембрану, ускоряет ее окислительный распад. Кроме того инсулин ускоряет синтез гликогена в печени и мышцах, синтез липидов из промежуточных продуктов распада углеводов, синтез белков из глюкогенных аминокислот. Одновременно инсулин тормозит гликогенолиз, липолиз, глюконеогенез, распад белков. Таким образом, инсулин, является гипогликемическим фактором, т.е. он понижает уровень глюкозы в крови.
Гормон поджелудочной железы глюкагонявляется антагонистом инсулина. Он ускоряет гликогенолиз и глюконеогенез в печени, распад жиров и белков и одновременно тормозит синтез гликогена, липогенез и протеиногенез. Аналогичным образом действует адреналин мозгового слоя надпочечников.
Глюкокортикоиды коры надпочечников ускоряют глюконеогенез, индуцируя синтез ферментов, участвующих в этом метаболическом пути. Эти гормоны также активируют гликогенолиз, липолиз, снижают проницаемость клеточных мембран кожи, жировой ткани, лимфоидных органов, соединительной ткани для глюкозы и аминокислот.
В регуляции углеводного обмена также принимают участие соматотропный гормон передней доли гипофиза, тироксин щитовидной железы. Они также как глюкагон, адреналин и глюкокортикоиды, способствуют повышению уровня глюкозы в крови, являясь гипергликемическими факторами.
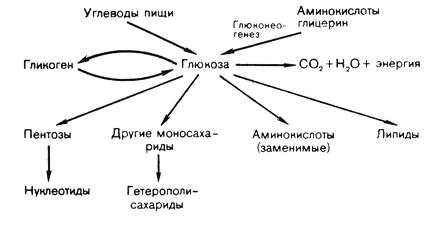
Рис. 10. Источники получения и использования глюкозы в организме животных.
Между действием вышеуказанных гормонов устанавливается динамическое равновесие, регулируемое центральной нервной системой. Таким образом, осуществляется общая нейрогуморальная регуляция углеводного обмена.
· НАРУШЕНИЯ ОБМЕНА УГЛЕВОДОВ
Нарушения углеводного обмена выражаются в гипергликемии, гипогликемии, глюкозурии, гликогенозах, непереносимостью лактозы, сахарозы.
Частым симптомом различных заболеваний, связанных с нарушением эндокринной системы является гипергликемия (повышенное содержание глюкозы в крови). Она наблюдается при недостатке инсулина поджелудочной железы. Мышечная ткань в этом случае теряет способность утилизировать глюкозу крови. Гипергликемия отмечается также при гипофизарных заболеваниях, опухолях коры надпочечников, гиперфункции щитовидной железы, заболеваниях печени, при беременности.
Гипогликемияможет наблюдаться при аденомах поджелудочной железы (в результате повышенной секреции инсулина), при аддисоновой болезни, гипотиреозе, голодании, длительной физической нагрузке.
Низкий уровень глюкозы в крови иногда регистрируется при беременности и лактации.
Нарушение углеводного обмена отмечается при гипоксических состояниях. При нарушении кровообращения, дыхания, снижении активности окислительно-восстановительных ферментов, интоксикациях, инфекциях, авитаминозах и гиповитаминозах наблюдается отставание скорости окисления пирувата от интенсивности гликолиза. Накопление при этом пирувата и лактата в крови приводит к изменению кислотно-щелочного равновесия и снижает щелочной резерв крови.
Наличие глюкозы в моче (глюкозурия) является следствием нарушения углеводного обмена в результате патологических изменений в поджелудочной железе (сахарный диабет, острый панкреатит). Также встречается глюкозурия почечного происхождения, связанная с недостаточностью резорбции глюкозы в почечных канальцах. При отравлениях морфином, стрихнином, хлороформом, фосфором также отмечается глюкозурия.
Гликогенозы – это заболевания, связанные с нарушением распада гликогена. В этом случае гликоген накапливается в клетках в больших количествах и разрушает их. Одной из причин гликогенозов является недостаточная активность фермента глюкозо-6-фосфатазы в печени и почках. При этом в результате гипогликемии появляются судороги, задержка роста, возможен ацидоз. В крови отмечается повышенное содержание пировиноградной и молочной кислот.
· КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ:
«ОБМЕН УГЛЕВОДОВ»
1. Назовите ферменты, участвующие в расщеплении крахмала, гликогена, клетчатки, сахарозы и лактозы в организме сельскохозяйственных животных.
2. В чем состоит значение анаэробного гликолиза. Укажите пункты субстратного фосфорилирования в ходе этого процесса.
3. В чем заключается преимущество аэробного пути утилизации глюкозы по сравнению с анаэробным? В каких тканях, и при каких условиях метаболизм глюкозы протекает преимущественно по анаэробному пути?
4. С кормом животное получило углеводов, эквивалентное 720 г глюкозы. Рассчитайте возможный выход АТФ, если окисление глюкозы происходило: а) в анаэробных условиях; б) в аэробных условиях?
5. С кормом животное получило 342 г сахарозы. Рассчитайте возможный выход АТФ, если окисление продуктов гидролиза сахарозы происходило: а) в анаэробных условиях; б) в аэробных условиях.
6. Какова роль пентозофосфатного пути метаболизма углеводов. Назовите регуляторные механизмы окислительной и неокислительной ветви ПФП.
7. Назовите основные неуглеводные предщественники глюкозы. Какова биологическая роль глюконеогенеза?
8. В чем заключается значение метилмалонатного пути для жвачных животных?
9. В чем состоит разница при использовании гликогена в мышечной ткани и печени? Ответ аргументировано обоснуйте.
10. Каково в норме содержание глюкозы в крови сельскохозяйственных животных? Укажите механизмы поддержания нормального уровня глюкозы в крови. Назовите основные причины гипергликемии и глюкозурии.
Глава 4
ОБМЕН ЛИПИДОВ
· Понятие о липидах и их биологическая роль.
· Переваривание и всасывание липидов.
· Метаболизм глицерина.
· Катаболизм жирных кислот.
· Метаболизм кетоновых тел.
· Обмен холестерина.
· Биосинтез липидов.
· Регуляция обмена липидов.
· Нарушения обмена липидов.
· ПОНЯТИЕ О ЛИПИДАХ И ИХ БИОЛОГИЧЕСКАЯ РОЛЬ
Липиды – это относительно разнородная в химическом плане группа органических веществ, нерастворимых в воде и растворимых в некоторых органических растворителях (бензин, бензол, ацетон, эфир и др.). В зависимости от способности к щелочному гидролизу различают омыляемые и неомыляемые липиды. К омыляемым относят жиры (триглицериды, триацилглицерины), воски, фосфолипиды, гликолипиды. По химической природе жиры и воски представляют собой простые эфиры, состоящие из 2-х компонентов – остатка спирта и остатка (остатков) жирной кислоты. Фосфолипиды и гликолипиды являются представителями сложных липидов. В их состав помимо спирта и жирной кислоты входят остаток фосфорной кислоты, аминоспирта или аминокислоты (у фосфатидов) или углеводный компонент (у гликолипидов). К неомыляемым липидам относят стериды. По химической природе это простые эфиры, образованные полициклическими спиртами стеринами и жирными кислотами.
В организме животных содержание липидов колеблется в пределах от 10,5 до 23 %.
Биологическая роль липидов многообразна. Они являются источниками энергии (при окислении 1 г жира высвобождается 9,3 ккал энергии), входят в состав клеточных мембран, выполняют защитную функцию, терморегуляторную, для некоторых соединений являются растворителями (для витаминов А, D, E, F, K, Q). При окислении 100 г жира выделяется 107 г эндогенной воды.
· ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ ЛИПИДОВ
Переваривание различных липидов имеет свои особенности.
Переваривание триглицеридов (жиров).
В ротовой полости корма, содержащие жиры, механически измельчаются, перемешиваются, смачиваются слюной и превращаются в пищевой ком. В составе слюны нет ферментов, расщепляющих триглицериды корма. У взрослых животных жиры проходят через желудок также без особых изменений, поскольку содержащаяся в желудочном соке липаза малоактивна. Величина рН желудочного сока около 1,5, а оптимальное значение для действия желудочной липазы находится в пределах 5,5 – 7,5. Кроме того, липаза может активно гидролизовать только предварительно эмульгированные жиры, а в желудке отсутствуют условия для эмульгирования. Переваривание жиров в полости желудка играет важную роль у новорожденных, рН желудочного сока у них около 5,0, что способствует перевариванию эмульгированного жира молока желудочной липазой.
Расщепление триглицеридов, входящих в состав корма, у взрослых животных происходит преимущественно в верхних отделах тонкого кишечника, где имеются весьма благоприятные условия для эмульгирования жиров. Наиболее мощным эмульгирующим действием на жиры обладают соли желчных кислот, поступающие в двенадцатиперстную кишку с желчью. Желчные кислоты образуются в печени из холестерина. В желчи содержатся холевая, дезоксихолевая, хенодезоксихолевая, литохолевая кислоты. Желчные кислоты присутствуют в желчи в свободной и конъюгированной (в виде парных соединений соответстветствующей желчной кислоты с глицином или таурином) формах. Соотношение конъюгатов может меняться в зависимости от характера корма: в случае преобладания в них углеводов увеличивается относительное содержание глициновых конъюгатов, а при белковом кормлении – тауриновых. Соли желчных кислот резко уменьшают поверхностное натяжение на границе раздела жир/вода, благодаря чему они не только вызывают эмульгирование, но и стабилизируют уже образовавшуюся эмульсию.
Желчные кислоты выполняют также важную роль в качестве своеобразного активатора панкреатической липазы, под влиянием которой происходит расщепление жиров в кишечнике. Вырабатываемая в поджелудочной железе липаза расщепляет жиры, находящиеся в эмульгированном состоянии. Активирующее влияние желчных кислот на липазу состоит в смещении рН для действия данного фермента с 8,0 до 6,0, т.е. до той величины, которая постоянно поддерживается в двенадцатиперстной кишке в ходе переваривания жиров.
Полный гидролиз триглицеридов происходит постадийно: сначала быстро гидролизуюся a- и a½-связи, а затем медленно идет гидролиз b-моноглицеридов.
В расщеплении жиров может также участвовать и кишечная липаза, однако активность ее невысока. Таким образом основными продуктами, образующимися в тонком кишечнике при расщеплении жиров корма являются глицерин, жирные кислоты, b-моноглицериды.
У взрослых жвачных животных переваривание липидов корма осуществляется главным образом липазами микроорганизмов рубца. Образовавшиеся в ходе расщепления липидов жирные кислоты поступают в кишечник, откуда всасываются и используются для ресинтеза липидов. Кроме того, у жвачных в кишечнике происходит утилизация липидов микроорганизмов за счет панкреатической липазы. Так как микрофлора рубца жвачных восстанавливает экзогенные ненасыщенные жирные кислоты, то снабжение животного ненасыщенными жирными кислотами происходит в основном за счет липидов микроорганизмов.
Переваривание стеридов. Стериды корма эмульгируются под действием тех же факторов, что и триглицериды, после чего расщепляются ферментом холестеринэстеразой до холестерина и высших жирных кислот. Стериды, содержащие остатки насыщенных жирных кислот, расщепляются труднее.
Переваривание фосфатидов. Фосфатиды корма эмульгируются под влиянием тех же веществ, что жиры и стериды. Гидролитическое расщепление фосфатидов происходит под влиянием фосфолипаз А, В, С, D, синтезируемых поджелудочной железой. Каждый фермент действует на определенную сложноэфирную связь фосфатида. Продуктами расщепления фосфатидов являются глицерин, высшие жирные кислоты, фосфорная кислота, аминоспирты (холин, этаноламин) или аминокислота серин.
¯ А1 О
СН2 – О ¾ С // ¾ R1 R1 – остаток насыщенной жирной кислоты
½
½ ¯А2 О
СН¾О ¾ С// ¾ R2 R2 – остаток ненасыщенной жирной кислоты
½
½ ¯C О ¯D
СН2¾О ¾ Р// ¾ О ¾ Х Х – азотсодержащий компонент (холин, этаноламин
½ или серин)
ОН
Всасывание липидов. Большинство продуктов расщепления липидов корма всасываются в нижней части двенадцатиперстной и в верхней части тощей кишки. Продукты расщепления липидов всасываются эпителием ворсинок с помощью диффузии, осмоса, активного транспорта и пиноцитоза.
Продукты переваривания липидов корма состоят из мелких частиц жира, ди- и моноглицеридов, высших жирных кислот, глицерина, глицеролфосфатов, азотистых оснований (холина, этаноламина, серина), холестерина, высших спиртов, фосфорной кислоты и др. компонентов. Они распределяются в двух фазах: липидной и мицеллярной (рис. 11). В липидной фазе основными компонентами являются мельчайшие частицы ди- и триглицеридов, в мицеллярной – высшие жирные кислоты, моноглицериды и другие продукты расщепления липидов.
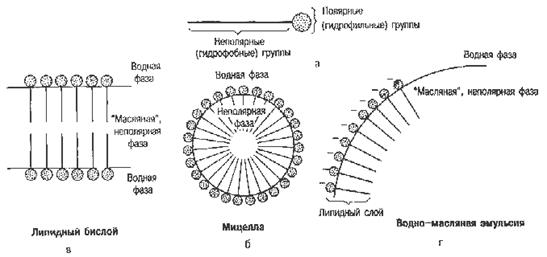
Рис. 11. Строение липидной и мицеллярной фаз.
Продукты переваривания липидов всасываются неодинаково. Легко всасываются глицерин, глицерофосфаты. Фосфорная кислота всасывается в виде натриевых и калиевых солей. Азотистые основания всасываются при участии цитидиндифосфата (ЦДФ). Жирные кислоты с короткой углеродной цепью (менее 10 атомов С) будучи хорошо растворимыми в воде свободно всасываются в кишечнике и поступают в кровь воротной вены, а оттуда в печень без каких-либо превращений в кишечной стенке. В процессе всасывания жирных кислот с длинной углеродной цепью и моноглицеридов, нерастворимых в воде, важная роль принадлежит желчным кислотам. В желчи соли желчных кислот, фосфатиды и холестерин находятся в соотношении 12,5:2,5:1. Жирные кислоты с длинной цепью и моноглицериды в просвете кишечника образуют с этими соединениями устойчивые в водной среде мицеллы. Структура этих мицелл такова, что их гидрофобное ядро (жирные кислоты, моноглицериды) оказывается окруженным снаружи гидрофильной оболочкой из желчных кислот и фосфатидов. Размеры мицелл примерно в 100 раз меньше самых мелких эмульгированных капель. В составе мицелл высшие жирные кислоты и моноглицериды переносятся с места гидролиза жиров к всасывающей поверхности кишечного эпителия. Здесь происходит распад жировых мицелл, при этом желчные кислоты сразу же поступают в ток крови и через систему воротной вены попадают в печень, откуда они вновь секретируются в составе желчи, т.е. происходит постоянная циркуляция желчных кислот между печенью и кишечником. В желчи содержится небольшая часть желчных кислот (10 – 15 % от общего количества), вновь синтезированных печенью. Основная масса желчных кислот (85 – 90 %) реабсорбируются в кишечнике и повторно секретируются в составе желчи.
В стенке кишечника жирные кислоты и моноглицериды снова превращаются в триглицериды. Здесь также происходит ресинтез фосфатидов (через стадию образования фосфатидной кислоты). Ресинтезированные в эпителиальных клетках кишечника триглицериды и фосфатиды, а также поступивший в эти клетки из полости кишечника холестерин (здесь он может частично этерифицироваться) соединяются с небольшим количеством белка и образуют относительно стабильные комплексные частицы – хиломикроны. Они содержат 2 % белка, 7 % фосфатидов, 8 % холестерина и свыше 80 % триглицеридов. Диаметр хиломикронов колеблется от 100 до 5000 нм. Благодаря большим размерам частиц хиломикроны не способны проникать из эндотелиальных клеток кишечника в кровеносные капилляры и они диффундируют в лимфатическую систему кишечника, а из нее в грудной лимфатический проток, из которого – в кровяное русло. Печень и жировая ткань играют наиболее существенную роль в дальнейшей судьбе хиломикронов. Последние свободно диффундируют из плазмы крови в межклеточные пространства печени (синусоиды). Гидролиз хиломикронов происходит как внутри печеночных клеток, так и на их поверхности. Хиломикроны из-за своих размеров не могут проникать в клетки жировой ткани. В связи с этим триглицериды хиломикронов подвергаются гидролизу на поверхности эндотелия капилляров жировой ткани при участии липопротеидлипазы, которая тесно связана с поверхностью эндотелия капилляров. В результате гидролиза образуются глицерин и жирные кислоты. Часть жирных кислот проникает внутрь жировых клеток, а часть связывается с альбуминами сыворотки крови и уносится с ее током. Покидать жировую ткань с током крови может и глицерин. Схема транспорта липидов указана на рис. 12.
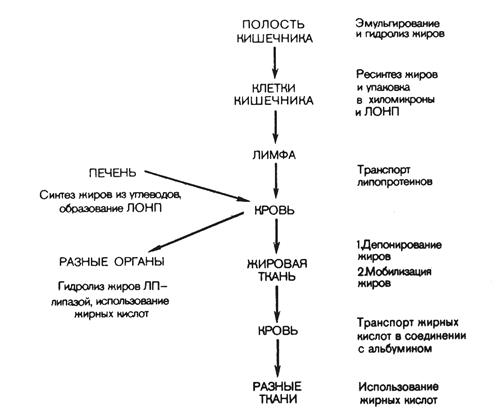
Рис. 12. Транспорт липидов и их использование в тканях.
· МЕТАБОЛИЗМ ГЛИЦЕРИНА
Глицерин образуется в тканях организма животных в результате расщепления триглицеридов под действием тканевых липаз. Функционирование этих ферментов активируется АКТГ гипофиза, адреналином мозгового слоя надпочечников, глюкагоном поджелудочной железы, тирозином щитовидной железы. Посредником в гормональной активации тканевых липаз служит цАМФ. В жировой ткани и печени обнаружены также липазы, отличные от гормоночувствительной липазы.
Глицерин может быть использован в процессах синтеза липидов, глюконеогенеза, а также может окисляться в зависимости от условий до L-лактата или СО2 и Н2О.
В каждом случае использование глицерина идет через глицеролкиназную реакцию, в результате которой образуется глицерол-3-фосфат (Г-3-Ф):
СН2 ¾ ОН СН2 ¾ ОН
| АТФ ½
СН ¾ ОН ¾¾¾¾® СН ¾ ОН OН
| глицеролкиназа ½ ½
СН2¾ ОН АДФ СН2¾ О ¾ Р = О
½
ОН
Глицерин Глицерол-3-Фосфат
Далее глицерол-3-фосфат может вовлекаться в липогенез (при взаимодействии с активированными жирными кислотами) или окисляться под действием глицеролфосфатдегидрогеназы с образованием дигидроксиацетонфосфата (ДАФ):
СН2 ¾ ОН СН2¾ ОН
½ НАД+ ½
СН ¾ ОН OН ¾¾¾¾¾® С = О ОН
½ ½ глицеролфосфатДГ ½ ½
СН2¾ О ¾ Р = О СН2¾ О ¾ Р = О
½ НАДН(Н+) ½
ОН ОН
Глицерол-3 –фосфат ДАФ
ДАФможет использоваться для биосинтеза липидов, в процессе глюконеогенеза или вовлекается в гликолитический путь.
В последних двух случаях ДАФ под действием триозофосфатизомеразы (ТФИ) превращается в глицеральдегид-3-фосфат (ГА-3-Ф):
О
СН2 ¾ ОН С// - Н
½ ½
С = О ОН ¾¾¾¾¾¾¾® Н ¾ С ¾ ОН ОН
½ ½ ТФИ ½ ½
СН2¾ О ¾ Р = О СН2 ¾ О ¾ Р = О
½ ½
ОН ОН
ДАФ ГА-3-Ф
В процессе глюконеогенеза ДАФ и ГА-3-Ф реагируют между собой с образованием фруктозо-1,6-дифосфата (Ф-1,6-Ф) при участии фермента альдолазы. В дальнейшем Ф-1,6-Ф под действием фруктозо-1,6-дифосфатазы превращается во фруктозо-6-фосфат (Ф-6-Ф), который изомеризуется в глюкозо-6-фосфат (Г-6-Ф). Реакция катализируется глюкозофосфатизомеразой (ГФИ). На Г-6-Ф действует глюкозо-6-фосфатаза (фермент присутствует в печени), в результате чего образуется свободная глюкоза.
Н2О Н2О
ДАФ + ГА-3-Ф ® Ф-1,6-Ф ¾¾¾® Ф-6-Ф ¾¾¾® Г-6-Ф ¾¾¾® глюкоза
Н3РО4 Н3РО4
Для образования одной молекулы глюкозы необходимы 2 молекулы глицерина. Таким образом в организме жиры могут превращаться в углеводы (при недостатке последних в рационе). Однако это превращение носит ограниченный характер.
В случае окислительного пути распада ГА-3-Ф вовлекается в гликолитический путь:
НАД, Н3РО4 АДФ АДФ
ГА-3-Ф ¾¾¾® 1,3-ДФГ¾¾¾® 3-ФГ ¾¾¾® 2-ФГ ¾¾¾® ФЕП ¾¾¾® пируват
НАДН(Н+) АТФ Н2О АТФ
В анаэробных условиях пируват превращается в L-лактат. Конечными продуктами окисления глицерина (в расчете на одну молекулу) в анаэробных условиях являются 1 молекула L-лактата и 1 молекула АТФ (2 молекулы АТФ образуются на уровне субстратного фосфорилирования и одна затрачивается при фосфорилировании глицерина).
В аэробных условиях пируват в митохондриях подвергается окислительному декарбоксилированию с образованием СО2, НАДН(Н+) и активной уксусной кислоты (ацетил-КоА). НАДН(Н+) поступает в дыхательную цепь, где образуется Н2О и АТФ (на уровне окислительного фосфорилирования), а ацетил-КоА окисляется в ЦТК (здесь образуются 2 молекулы СО2, 1 молекула АТФ на уровне субстратного фосфорилирования, 3 молекулы НАДН(Н+) и 1 молекула ФАДН2). Восстановленные коферменты далее окисляются в дыхательной цепи. Образуется Н2О и АТФ (11 молекул на уровне окислительного фосфорилирования). Таким образом, конечными продуктами аэробного окисления глицерина являются СО2, Н2О и АТФ (22 молекулы).
Таблица 4. Выход АТФ при окислении глицерина в аэробных условиях.
| Реакция | Изменение количества АТФ в расчете на 1 молекулу глицерина |
| Глицерин ® глицерол-3-фосфат | - 1 |
| Глицерол-3-фосфат® дигидроксиацетонфосфат | 1 НАДН(Н+) + 3 (окислительное фосфорилирование) |
| Глицеральдегид-3-фосфат® 1,3-дифосфоглицерат | 1 НАДН(Н+) + 3 (окислительное фосфорилирование) |
| 1,3-дифосфоглицерат ® 3-фосфоглицерат | + 1 (субстратное фосфорилирование) |
| Фосфоенолпируват ® пируват | + 1 (субстратное фосфорилирование) |
| Пируват ® ацетил- КоА + НАДН(Н+) | 1 НАДН(Н+) + 3 (окислительное фосфорилирование) |
| Окисление ацетил-КоА в ЦТК | + 1 (субстратное фосфорилирование) |
| Окисление НАДН(Н+) и ФАДН2 (образовавшихся в ЦТК) в дыхательной цепи на уровне окислительного фосфорилирования | 3 НАДН(Н+) + 9 1 ФАДН2 + 2 |
| Итого | +22 АТФ |
· КАТАБОЛИЗМ ЖИРНЫХ КИСЛОТ
Известны 3 типа окислительных превращений жирных кислот: a-, b- и w-окисление.
Процесс b-окисления жирных кислот, являющийся главным поставщиком энергии, активно протекает в печени, почках, скелетной и сердечной мышцах, в жировой ткани. В тканях мозга скорость окисления жирных кислот незначительная, основным источником энергии здесь служит глюкоза.
Процесс окисления жирных кислот складывается из следующих этапов: активация жирных кислот, транспорт их в митохондрии и внутримитохондриальное b-окисление.
Активация жирных кислот. Свободная жирная кислота, независимо от длины углеродной цепи, является метаболически инертной и не может подвергаться биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация происходит на наружной поверхности мембраны митохондрий при участии АТФ, КоA-SH и Mg2+. Реакция катализируется ацил-КоА-синтетазой:
О АТФ, КоА-SH, Mg2+ О
R – СН2 ¾ СН2 ¾ С// – ОН ¾¾¾¾¾¾® R – СН2 ¾ СН2 ¾ С// ~ S – КоА
АМФ, Н4Р2О7
Этот процесс происходит через стадию образования ацил-аденилата жирной кислоты.
Транспорт активированных жирных кислот в митохондрии через внутреннюю митохондиральную мембрану осуществляется при помощи карнитина.
Карнитин взаимодействует с активированной жирной кислотой при участии фермента ацил-КоА-карнитинацилтрансферазы. В результате реакции образуется ацилкарнитин, который проникает через внутреннюю митохондриальную мембрану и взаимодействует с внутримитохондриальным КоА-SH. При этом образуется активированная кислота и свободный карнитин.
Процесс b-окисления жирных кислот в митохондриях состоит из нескольких последовательных реакций, составляющих цикл, в результате которого активированная жирная кислота (ацил-КоА) укорачивается на 2 углеродных атома, выделяющихся в форме активной уксусной кислоты (ацетил-КоА). Каждый цикл включает 4 этапа: окисление с помощью ФАД-зависимых дегидрогеназ, гидратацию, окисление при помощи НАД-зависимых дегидрогеназ и тиолазное расщепление.
На первом этапе образуется непредельная активированная жирная кислота (транс-форма еноил-КоА), которая далее подвергается гидратации при участии фермента еноил-КоА-гидратазы. В результате реакции образуется L-b-гидроксиацил-КоА. На 3-м этапе он окисляется с помощью L-b-гидроксиацил-КоА-дегидрогеназы и кофермента НАД+. Образовавшийся b-кетоацил-КоА на последнем этапе подвергается тиолизу, в результате чего образуются ацетил-КоА и ацил-КоА (имеющий на 2 атома С меньше по сравнению с исходной кислотой).
Н
О ФАД ½ О
R – CН2 - СН2 – СН2 – С// ~ S – КоА ¾¾® R – CН2 - С = С – С// ~ S – КоА ¾¾®
Ацил-КоА ФАДН2 ½
Н
транс-форма еноил-КоА
ОH O O
Н2О ½ // НАД //
¾¾® R – CН2 - С – СН2 – С ~ S – КоА ¾¾® R – CН2 - С – СН2 – С ~ S – КоА¾¾®
½ НАДН(Н+) úú
H О
L-b-гидроксиацил-КоА b-кетоацил-КоА
O O
КоА-SH // //
¾¾® R – CН2 – С ~ S – КоА + CH3 - C ~ S – КоА
ацил-КоА
(укороченный на 2 атома С) ацетил-КоА
Ацетил-КоА поступает в ЦТК, где окисляется, ФАДН2 и НАДН(Н+), образованные соответственно на 1-м и 3-м этапах цикла b-окисления, идут в дыхательную цепь, где происходит их окисление, сопряженное с синтезом АТФ. Образовавшийся ацил-КоА поступает в очередной цикл b-окисления, в конце которого опять происходит укорачивание его цепи на 2 атома С. Так повторяется до тех пор, пока в последний цикл не вовлекается активная масляная кислота (бутирил-КоА). Она проходит те же этапы, но на последнем (тиолазное расщепление b-кетобутирил-КоА) образуются 2 молекулы ацетил-КоА. Конечными продуктами расщепления жирных кислот являются СО2, Н2О и АТФ.
Выход АТФ при окислении жирных кислот с четным числом атомов углерода можно рассчитать по формуле:
[12 ´ n2 + 5 ´ (n2 - 1)] - 1, где
n – число атомов С в жирной кислоте;
12 – количество молекул АТФ, образующихся при окислении ацетил-КоА;
n2 – количество молекул ацетил-КоА, образованных в ходе b-окисления жирной кислоты;
(n2 - 1) - количество циклов b-окисления;
5 – количество молекул АТФ, образующихся при окислении ФАДН2 (2 молекулы) и НАДН(Н+) (3 молекулы);
1 – количество молекул АТФ, затраченных на активирование жирной кислоты.
Окисление насыщенных жирных кислот с нечетным числом атомов углерода протекает аналогичным образом с той лишь разницей, что в последний цикл b-окисления вовлекается активная валериановая кислота, а на последнем этапе образуются ацетил-КоА и пропионил-КоА. Активная пропионовая кислота далее превращается в активную янтарную кислоту (сукцинил-КоА) в результате функционирования метилмалонатного пути. Сукцинил-КоА через оксалоацетат может далее вовлекаться в глюконеогенез.
Ненасыщенные жирные кислоты с четным числом атомов углерода окисляются также, как и насыщенные. Однако для их полного окисления необходимы дополнительные ферменты, превращающие цис-конфигурацию двойных связей в трансконфигурацию и перемещающие двойную связь из 3-го цис- во 2-е транс- положение. Это связано с тем, что природные ненасыщенные жирные кислоты имеют цис-конфигурацию двойных связей, а образующиеся при b-окислении – транс-конфигурацию. При b-окислении ненасыщенной жирной кислоты, в результате поэтапного отщепления двухуглеродных фрагментов в виде ацетил-КоА, образуется в зависимости от расположения двойных связей в исходной кислоте, либо 2,3 – цис-производное, либо 3,4-цис-производное ацил-КоА. При присоединении воды к 2,3-цис-производному ацил-КоА образуется D-стереоизомер b-гидроксиацил-КоА, который не окисляется L-b-гидроксиацил-КоА-дегидрогеназой, специфичной только к L-стереоизомеру. Поэтому D-стереоизомер преращается под действием фермента эпимеразы в L-изомер, который и подвергается дальнейшим превращениям. Если при окислении ненасыщенной жирной кислоты образуется 3,4 – цис – ацил-КоА, тогда он превращается в 2,3 – транс – ацил – КоА при участии фермента транс-изомеразы. Такое превращение происходит в процессе окисления олеиновой кислоты (С18), имеющей одну двойную связь в 9-м положении. Вначале протекают 3 цикла b-окисления как и у насыщенных жирных кислот, в результате чего образуется активированная кислота с С12 и двойной связью в 3,4-цис-положении. Затем под действием транс-еноил-КоА-изомеразы образуется транс-D2-еноил-КоА, подвергающийся дальнейшим превращениям.
В тканях организма животных помимо b-окисления жирных кислот протекают процессы a- и w-окисления.
a-окисление жирных кислот происходит в мозге. Реакции образования a-гидроксикислот катализируются ферментной системой, известной под названием монооксигеназы. При этом используется молекулярный кислород, Fe2+ и аскорбиновая кислота. a-гидроксипроизводные жирных кислот входят в состав цереброзидов и ганглиозидов головного мозга.
R – CН2 - СН2 – СН2 – СООН + О2 ® R – CН2 - СН2 – СН – СООН
½
ОН
a-гидроксикислоты могут подвергаться дегидрированию с образованием a-кетокислот, которые в свою очередь путем окислительного декарбоксилирования могут превращаться в кислоты с нечетным числом атомов углерода.
В процессе w-окисления окисляются жирные кислоты со средней длиной углеродной цепи и в меньшей степени с длинной цепью. Сначала образуются w-гидроксикислоты (окислению подвергается последний по отношению к карбоксильному атом углерода), которые затем могут превращаться в дикарбоновые кислоты.
· МЕТАБОЛИЗМ КЕТОНОВЫХ ТЕЛ
К кетоновым телам относятсяацетоуксусная кислота (ацетоацетат), b-гидроксимасляная кислота (b-гидроксибутират) и ацетон.
Ацетон образуется в результате декарбоксилиров
|
из
5.00
|
Обсуждение в статье: Биологическая роль глюконеогенеза |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

