 |
Главная |
Медико-биологическая роль комплексных соединений
|
из
5.00
|
Многие вещества, присутствующие в организме: аминокислоты, белки, нуклеиновые кислоты и их основания, витамины, гормоны, порфирины, – являются активными лигандами и, взаимодействуя катионами биометаллов, образуют многообразные комплексные соединения, выполняющие определенные биологические функции.
Некоторые природные комплексные соединения содержат в качестве хелатообразующего лиганда порфириновые производные, в которых за счет электронодонорных свойств четырех атомов азота образуются связи с комплексообразователем. В зависимости от природы комплексообразователя изменяются биологические функции этих комплексов.
Кровь содержит комплексное соединение железа – гемоглобин, в нем атом железа, имея одну «координационную вакансию», может связываться с молекулой кислорода. При железодефицитной анемии (малокровии) количество гемоглобина в крови снижается. Для лечения назначают прием препаратов железа. Наиболее эффективные, в которых железо связано в комплекс, например с аскорбиновой кислотой или никотинамидном (витамином РР).
Похожий на гемоглобин комплекс есть и в зеленых растениях: комплексы порфирина с катионом магния образуют активную часть молекулы хлорофилла (рисунок 8.3).
Рисунок 8.3.
Активная часть молекул гемоглобина и хлорофилла.
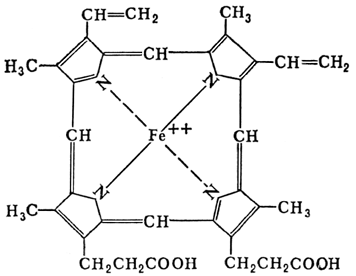
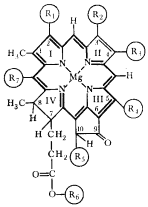
Связанные в комплексы ионы кобальта, молибдена, меди присутствуют в ферментах, без которых не может функционировать ни один живой организм. В организме постоянно происходит образование и разрушение жизненно необходимых биокомплексов, построенных из катионов «металлов жизни», или биометаллов и биолигандов. При этом за счет обмена с окружающей средой поддерживается на определенном уровне концентрация участвующих в этом равновесии веществ, обеспечивая состояние металлолигандного гомеостаза. Нарушение этого состояния смещает равновесие в ту или иную сторону, что приводит к изменениям в метаболизме организма.
Нарушение металлолигандного гомеостаза происходит по разным причинам: долговременное непоступление в организм катионов биогенных металлов или поступление их в значительно меньших количествах, чем необходимо для жизнедеятельности; поступление катионов биометаллов в количествах заметно больших, чем необходимо для жизнедеятельности.
Эти нарушения могут быть вызваны несбалансированным питанием или биогеохимическими особенностями территорий, где проживает человек.
Более серьезные нарушения в метаболизме организма вызываются поступлением катионов металлов-токсикантов (тяжелых металлов) или лигандов-токсикантов. В результате деятельности человека в окружающую среду поступают различные вещества. Существенную роль в загрязнении окружающей среды играют: электрохимические производства, поставляющие практически любые металлы-токсиканты, особенно ртуть, кадмий и хром; выхлопные газы автотранспорта – свинец; а также отходы металлургической и атомной промышленности, поставляющие широкий спектр различных металлов-токсикантов. Попадание их в организм может вызвать тяжелые последствия, например появление опухолей, мутагенез, нарушение обмена веществ.
Детоксикацию организма от металлов-токсикантов можно проводить при помощи лиганд-препаратов на основе полидентантных лигандов, которые образуют с токсикантами прочные водорастворимые комплексы (хелатотерапия).
Один из наиболее известных полидентантных лигандов – динатриевая соль этилендиаминтетрауксусной кислоты (другие названия: ЭДТА, комплексон ІІІ, трилон Б). Для связи с центральным атомом этот лиганд может использовать до шести центров: четыре атома кислорода карбоксильных групп и неподеленные пары электронов атомов азота.

Трилон Б
§8. Комплекснье соединения ионов металлов с органическими реагентами. Хелаты и ионные ассоциаты.
Обнаружение многих катионов и анионов осуществляют с помощью комплексообразующих органических реагентов (например, диацетилдиоксим служит для обнаружения Ni2+, ализарин - для обнаружения Аl3+, 8-оксихинолин –Mg2+, фенантролин – Fe3+, дитизон - Zn2+ и др.).
Для разделения катионов и анионов из водных растворов применяют органические реагенты. Для этого к водному раствору соли металла добавляют раствор органического лиганда и полученный комплекс экстрагируют из водной фазы в органический растворитель.
Условием экстрагируемости комплексов является образование ионных ассоциатов, которые могут экстрагироваться в органическую фазу. Примером использовния экстрагирующихся ассоциатов является экстракционно-фотометрическое определение бора в виде ионного ассоциата комплексного аниона [BF4]- - с катионом красителя метиленового голубого МГ: [МГ] +[BF4]-.
Образовавшийся ионный ассоциат является электронейтральным и экстрагируется органическим растворителем.
Электронейтральными являются многие внутрикомплексные (халатные) соединения, которые, как правило, хорошо растворимы в органических растворителях. Наиболее широко применяются для экстракции металлов такие хелатообразуюшие реагенты. Как дитизон, пиридил - азонафтол, диэтилтиокарбамид и т.д.
Комплексные соединения катионов с органическими реактивами называют клипексонами. Эти реакции сопровождаются образованием внутрикомплексных (хeлатных) соединений. Большое значение в аналитической химии имеет комплексон III(трилон Б), натриевая соль этилендиаминтетрауксусной кислоты (Na2H2Y).
Молекула органического лиганда должна иметь определенные специфические связи, сопровождающейся аналитическими эффектами (появление осадка, изменение окраски или то и другое вместе).
Эти группировки называют функционально – аналитическими группировками (ФАГ).

Пи рокатехин Пи рокатехин железа(III)
Согласно принципу Чугаева в комплексообразование вступают органические реагенты, даюшие с ионами металлов циклы. Чем больше циклов (4,5,6,7 и 8 – членных) образуется вокруг иона металлов тем устойчивее соединение.
Например, диметилглиоксим (диацетилдиоксим).

Аналитические свойства продукта реакции меняют аналитически активные группы (ААГ). Свойствами аналитически активных групп в органических лигандах обладают ауксохромные группы, влияющие на систему сопряженных π- связей и углубляющие окраску комплекса (Сl-, Вr-,I-С6Н5- и т.д.).
1- нитрозо-2-нафтол - реактив на Со2+ дает красно – бурый осадок.

Ализарин - реактив на AI3+ дает розово – красный осадок (алюминиевый лак).

Дитизон (дифенилтиокарбазон) реактив на Zn2+, Аg+,РЬ2+,Hg2+,Со2+и т.д.

Дифенилкарбазид, реактив на Hg2+

При выборе специфических реакций на ионы, обладающие собственной окраской, например, на ионы Ni2+, подходящим реагентом оказывается бесцветный диметилглиоксим, т.е. реагент не отличающийся хромоформными свойствами. Элементы, обладающие хромоформным действием (Ni2+, Co 2+, Fe3+, Cr 3+ и т.д.) дают с бесцветным органическими реагентами окрашенные соединения при образовании связей с кослородом (Кt-O-), с аминным азотом (Кt-N=), с сульфидной серой (Kt - S -). Органические реагенты могут использоваться как комплексообразователи для маскироки ионов, т.е. для связывания в комплексы тех ионов, которые мешают проведению реакций обнаружения других ионов.
Например, ионы Fe 3+ маскируют реакции обнаружения Со 2+ реакцией с роданидом аммония.
Так, обнаружению Со2+ с роданидом (тиоцианатом) аммония мешают ионы Fe3+. Тогда ионы Fe3+ маскируют взаимодействие с тартратами (солями винной кислоты) или фторидами.
Однако, ионы Fe3+ также реагируют с роданидом аммония, образуя кроваво – красное окрашивание, которое делает незаметным ее окрашивание, вызываемое ионами Со2+. С целью маскировки Fe3+ в раствор добавляют маскирующие реагенты фториды, фосфаты, оксалаты и т. д., образующие с ионами Fe3+ сильно-кислой среде устойчивые комплексные анионы, такие как [Fe Fe6]3-,[Fe (P04 )2]3-, [Fe (C204)3]3-.
В качестве маскирующих реагентов используют такие органические комплексообразователи как тиомочевина, гидроксиламин, винная, лимонная комплексоны.
Лабораторная работа.
«Анализ смеси анионов І-ІІI группы»
Предварительные испытания
Определение рН раствора. В кислой среде не могут находиться ионы СО32–, так как соли угольной кислоты разлагаются под действием кислот.
Выявление анионов I группы
К порции анализируемого раствора в нейтральной или слабощелочной среде прибавить несколько капель хлорида бария. Если образуется осадок, то анионы 1 группы присутствуют.
Выявление анионов II группы
К порции анализируемого раствора, подкисленного до кислой среды азотной кислотой, прилить несколько капель нитрата серебра. Образование осадка укажет на наличие анионов II группы.
Выявление отдельных анионов
1) Выявление анионов SO42–
К 3-4 каплям анализируемого раствора прилить избыток соляной кислоты и 2-3 капли хлорида бария. Образование белого мелкокристаллического осадка укажет на присутствие иона SO42–.
2) Выявление аниона СО32–
К 8-10 каплям анализируемого раствора прилить избыток соляной кислоты. Пробирку закрыть газоотводной трубкой и поместить в водяную баню. Другой конец газоотводной трубки поместить в известковую воду. Помутнение известковой воды укажет на наличие анионов СО32–.
3) Выявление анионов I–
Открытие аниона I– основано на окислении ионов I– до свободного состояния. Проводится двумя реактивами:
а) Хлорная вода в кислой среде.
К 3-4 каплям анализируемого раствора прилить 2-3 капли серной кислоты, 3-4 капли бензола и затем прилить по каплям хлорную воду. После каждой капли хлорной воды содержимое пробирки энергично встряхивать. Окрашивание бензола в красно-фиолетовый цвет укажет на присутствие аниона I– в растворе:
2I– + Cl2 = I2 + 2Cl–.
б) Нитритами в кислой среде.
К 3-4 каплям анализируемого раствора прилить 2-3 капли серной киcлоты, 3-4 капли нитрита натрия или калия и 1-2 капли крахмального раствора. Появления синей окраски кажет на наличие свободного йода:
2I– + 2KNO2 + 2H2SO4 = I2 + 2NO + 2H2O + K2SO4.
Если в анализируемом растворе обнаружены анионы I–, то их необходимо удалить, так как они мешают выявлению анионов Br– и РО43–.
4) Удаление анионов I– и выявление анионов Br–
Удаление анионов I– основано на их окислении до свободного йода с последующим удалением его из раствора при кипячении.
В фарфоровую чашечку налить 5-6 капель анализируемого раствора, прибавить такое же количество серной кислоты и нитрита натрия или калия. Разбавить раствор 8-10 каплями воды и кипятить до полного обесцвечивания. Полноту удаления свободного йода проверить бумажкой, смоченной раствором крахмала (она не должна синеть). Затем проверить полноту удаления анионов йода хлорной водой.
К 1-2 каплям прокипяченного раствора, взятым в пробирку, прибавить 1-2 капли серной кислоты, 3-4 капли бензола и по каплям приливать хлорную воду, встряхивая пробирку после каждой капли. Если бензол при этом остается бесцветным то следовательно йод удален полностью и анионы брома в растворе отсутствуют. Если бензол окрашивается в желтый или оранжевый цвет, то в растворе имеются анионы брома. Если бензол принимает красно-фиолетовую окраску, значит ионы йода удалены не полностью. К раствору, оставшемуся в чашке, прибавить еще серной кислоты, нитрита и снова прокипятить, после чего вновь провести пробу на полноту удаления йода. После полного удаления йода открывать анионы брома, как указано выше.
5) Выявление анионов РО43–
Если в анализируемом растворе присутствуют анионы йода, то анионы РО43– открываются после удаления йода, а если анионы йода отсутствуют, то прямо из анализируемого раствора с двумя реактивами:
а) магнезиальной смесью в нейтральной или слабощелочной среде. Налить в пробирку 5-6 капель магнезиальной смеси и прибавлять по каплям раствор с удаленным йодом или исходный раствор при взбалтывании. Выпадение белого кристаллического осадка укажет на присутствие анионов РО43–.
б) Налить пробирку 5-6 капель молибденовой смеси, нагреть ее до 50-60 °С, прибавить 1-2 капли раствора (с удаленным йодом) или исходного раствора, дать постоять. Выпадение желтого кристаллического осадка укажет на присутствие анионов РО43–.
6) Выявление анионов хлора
К 3-4 каплям анализируемого раствора прибавить 2-3 капли азотной кислоты иизбыток нитрата серебра. Раствор нагреть почти до кипения. Осадок отцентрифугировать и провести пробу на полноту осаждения. Добившись полного осаждения, центрифугат слить с осадка. Осадок промыть 2-3 раза теплой водой до полного удаления катионов Ag+ (проба на HCl). Затем к промытому осадку прибавить 6-8 капель 12 %-ого раствора карбоната аммония и энергично взболтать содержимое пробирки, при этом AgCl частично растворяется с образованием [Ag(NH3)2]Cl. Осадок оставшийся отцентрифугировать, центрифугат слить в чистую пробирку и прибавить к нему несколько капель бромида калия. Помутнение раствора из-за выделения AgBr укажет на присутствие анионов Cl–.
Выявление аниона NO3– производится несколькими реактивами:
а) Дифениламином (C6H5)2NH.
К 1-2 каплям анализируемого раствора прилить 1-2 капли дифениламина, появление синего окрашивания укажет на присутствие NO3–. Если в растворе присутствуют анионы йода, окраска может быть затушевана коричневой окраской выделяющегося в результате окисления I2.
б) Цинковой пылью в щелочной среде.
К 3-4 каплям анализируемого раствора прибавить 2-3 капли концентрированной щелочи, добавить немного цинковой пыли (или порошкообразного алюминия) и нагреть. Выделение аммиака укажет на присутствие в растворе анионов NO3–. Аммиак можно обнаружить по посинению влажной универсальной индикаторной бумажки.
|
из
5.00
|
Обсуждение в статье: Медико-биологическая роль комплексных соединений |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

