 |
Главная |
Тестоввые задания для самостоятельного решения
|
из
5.00
|
Выберите один правильный ответ
001. СУММА КОЭФФИЦИЕНТОВ В ПРАВОЙ ЧАСТИ РЕАКЦИИ РАВНА
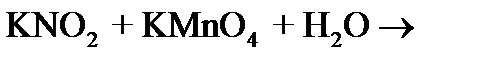
1) 5
2) 7
3) 8
4) 9
5) 10
002. ДЛЯ УСТАНОВЛЕНИЯ ТИРА KMnO4 ИСПОЛЬЗУЮТ
1) H2SO4, KI, I2
2) H2SO4, H2C2O4
3) NaOH, Na2SO3
4) K2Cr2O7, H2SO4
5) Na2B4O7
003. В ПЕРМАНГАНАТОМЕТРИИ ИСПОЛЬЗУЮТ ИНДИКАТОР:
1) метиловый оранжевый
2) фенолфталеин
3) крахмал
4) перманганат калия
5) эозин
004. В ХОДЕ ПЕРМАНГАНАТОМЕТРИЧЕСКОГО ТИТРОВАНИЯ ОКРАСКА РАСТВОРА МЕНЯЕТСЯ
1) от розовой до бледно-желтой,
2) от розовой до бесцветной,
3) от розовой до зеленовато-желтой
4) от бесцветной до бледно-желтой
5) от синей до розовой
005. НА ТИТРОВАНИЕ НАВЕСКИ 0,1133 Г Na2C2O4 (х.ч.) В КИСЛОЙ СРЕДЕ ПОШЛО 20,75 МЛ РАСТВОРА KMnO4. НОРМАЛЬНОСТЬ ЭТОГО РАСТВОРА СООТВЕТСТВУЕТ:
1) 0,0407 н
2) 0,0815 н
3) 0,0203 н
4) 0,015 н
5) 0,0316 н
006. МОЛЯPНАЯ МАССА ЭКВИВАЛЕНТА KMnO4 ПPИ ИСПОЛЬЗОВАНИИ ЕГО В КАЧЕСТВЕ ОКИСЛИТЕЛЯ В КИСЛОЙ СPЕДЕ РАВНА:
1) 158 г/моль
2) 79 г/моль
3) 52,6 г/моль
4) 31,6 г/моль
5) 22,6 г/моль
007. ПО МЕТОДУ ПЕРМАНГАНАТОМЕТРИИ МОЖНО ПРОВОДИТЬ КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
1) окислителей
2) восстановителей
3) кислот и оснований
4) окислителей и восстановителей
5) оксидов
Занятие №11
«ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ. ИОДОМЕТРИЯ»
Вопросы к занятию
1. Метод иодометрия. Сущность метода.
2. Приготовление и стандартизация рабочих растворов.
3. Применение иодометрии в медицинской практике и фармации.
Иодометрия
Иодометрия – это титриметрический метод определения окислителей и восстановителей, основанный на реакции
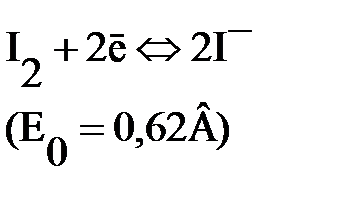
Йод плохо растворим в воде, но в присутствии йодид-ионов образуется комплекс I3-, поэтому при титровании протекает реакция
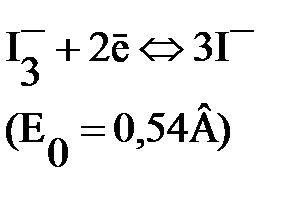
Стандартные потенциалы многих восстановителей меньше Е0(I3–/3I–), а многих окислителей – выше, поэтому система служит для определения и окислителей, и восстановителей.
Иодометрические методы основаны на применении стандартного раствора тиосульфата натрия для титрования иода, выделившегося при взаимодействии определяемого окислителя с избытком иодида калия (при титровании по замещению) или оставшегося в избытке при медленном взаимодействии определяемого восстановителя с фиксированным объемом стандартного раствора иода (в случае обратного титрования).
В иодометрии наибольшее значение имеет реакция взаимодействия йода с тиосульфатом натрия, протекающая по уравнению:
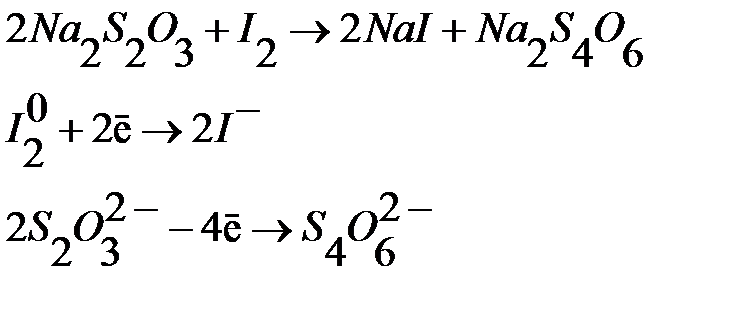
Продуктом реакции является тетратионат натрия Na2S4O6 – натриевая соль тетратионовой кислоты.
Йод в зависимости от концентрации окрашивает растворы от желтого до красно-бурого цвета. Для точного фиксирования точки эквивалентности в данной реакции применяют раствор крахмала, который добавляют перед концом титрования (когда раствор становиться бледно-желтым). Йод образует с крахмалом интенсивно синее соединение. В момент эквивалентности, когда восстанавливается весь йод, синяя окраска исчезает, и раствор становится бесцветным.
Прямая реакция восстановления йода идет быстро, но обратная реакция окисления иодида протекает во времени. Поэтому использовать для определения окислителей раствор иодида невозможно. К тому же растворы иодидов (КI) неустойчивые, поскольку иодид окисляется кислородом воздуха. Поэтому используют косвенный прием – добавляют к окислителю избыток иодида, а выделившийся йод оттитровывают стандартным раствором тиосульфатам натрия:
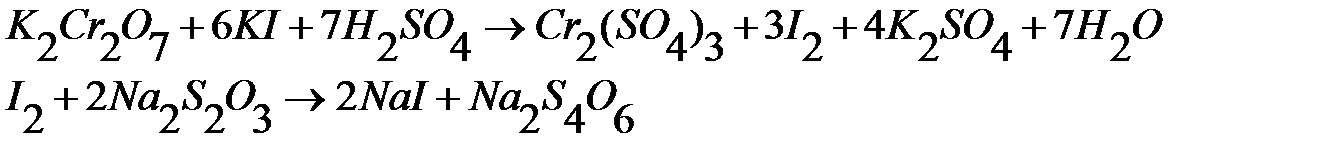
Непосредственное титрование тиосульфата раствором K2Cr2O7 невозможна из-за нестехиометричности реакции. Индикатором так же служит крахмал.
Йодометрические определения восстановителей проводят по методу обратного титрования. К анализируемому раствору добавляют титрованный раствор йода в избытке. С определяемым веществом реагирует эквивалентное количество йода, например
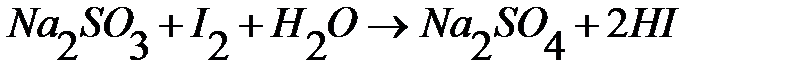
Избыток йода титруют рабочим раствором тиосульфата натрия. Зная общее количество йода и непрореагировавший избыток, рассчитывают количество йода, эквивалентное анализируемому веществу.
Прямое титрование сульфитов раствором йода обычно дает уменьшенные результаты, т.к. во время титрования часть сульфита окисляется кислородом воздуха.
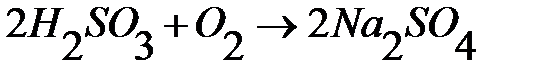
|
из
5.00
|
Обсуждение в статье: Тестоввые задания для самостоятельного решения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

