 |
Главная |
Кривые комплексонометрического титрования
|
из
5.00
|
Для того, чтобы правильно выбрать металлохромный индикатор, проводят расчет кривой комплексонометрического титрования, то есть определяют изменение концентрации ионов металла от количества добавленного титранта (расчет проводят ¸с учетом разбавления). Кривые титрования строят в координатах рМ - V - Р, где рМ = -¸или рМ lg[Mn+]; V – объём добавленного титранта, мл; Р – степень оттитрованности ионов металла, %.
Приведем расчет кривой титрования ионов металла раствором ЭДТА (трилона Б).
1. До точки эквивалентности концентрацию свободных ионов металла с достаточным приближением (без учета ионов металла, образующихся при диссоциации комплексона MYn-4) можно вычислить по формуле:

где СМ и СK – исходные молярные концентрации растворов иона металла и комплексона, моль/л; VM и VK – объёмы растворов ионов металла и комплексона в данный момент титрования, мл.
2. В точке эквивалентности расчет [Mn+] проводим исходя из условной константы устойчивости комплексоната при заданном значении рН (2.3). Так как в точке эквивалентности [Mn+] = C(Y), а [MYn-4] = CMVM/(VM+ VK), получим:
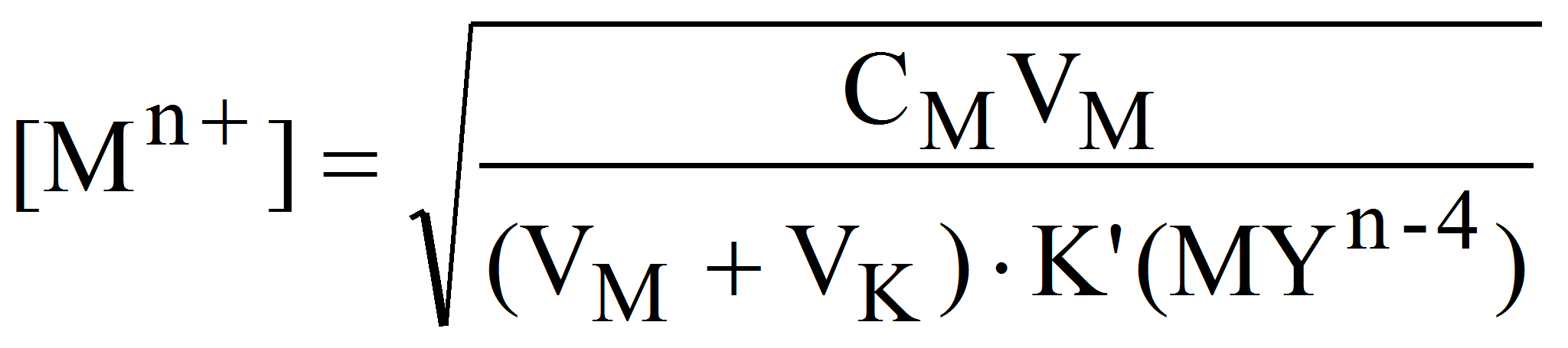
Поскольку при этом CMVM= CKVK, то:

После точки эквивалентности [Mn+] также рассчитывается из выражения для условной константы устойчивости :

Оценивая избыток свободного комплексона (без учета диссоциации комплексоната) как:

получим:

Форма кривой комплексонометрического титрования аналогична кривым титрования в других методах титриметрии (кислотно-основном, окислительно-восстановительном, осадительном), то есть на кривой наблюдается резкое изменение рМ вблизи точки эквивалентности – скачок титрования.
Величина скачка зависит:
1) от прочности образующегося комплексоната - чем больше константа устойчивости, то есть чем прочнее комплексонат, тем больше скачок (рисунок 2.3);
2) от кислотности среды – чем она выше, то есть чем меньше значение рН, тем меньше скачок; в кислой среде при титровании ионов металлов, образующих малоустойчивые комплексонаты (например, Ba2+, Mg2+, Ca2+) скачок на кривой титрование отсутствует и определение невозможно (рисунок 2.4);
3) от концентрации реагирующих веществ – чем больше концентрация титранта и определяемого иона, тем больше скачок;
4) от присутствия дополнительных комплексообразователей – чем их больше, тем меньше скачок.
Рисунок 2.3
Зависимость величины скачка на кривой комплексонометрического титрования от прочности образующегося комплексоната

Рисунок 2.4
Зависимость величины скачка на кривой комплексонометрического титрования ионов Са2+комплексоном от рН раствора

|
из
5.00
|
Обсуждение в статье: Кривые комплексонометрического титрования |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

