 |
Главная |
Титриметрические методы анализа
|
из
5.00
|
Неводное титрование:
Сущность метода. Титрант. Условия проведения титрования. Определение конечной точки титрования. Расчёты: молярной концентрации эквивалента, титра по определяемому веществу, массы определяемого вещества и содержания вещества в %.
| Сущность метода | Метод титрования, в котором средой служит неводный растворитель с минимальным содержанием воды. Как растворитель применяется обезвоженные органические жидкости или их смеси (ацетон например) |
| Титрант | Разные титранты в разных растворителях, например: HCLO4 |
| Условия проведения титрования. | С применением растворителя, так чтобы константа автопротолиза была наименьшей, с учётом кислотно-основных свойств растворителей, растворитель должен быть с высокой диэлектрической проницаемостью, растворитель не должен вступать в побочные реакции. |
| Определение конечной точки титрования. | Или визуальным индикаторным методом или потенциометрически. С использованием разных индикаторов: деметиламинобензол, кристаллический фиолетовый, малахитовый зелёный, Судан III, Топеолин 00, нейтральный красный. |
| Молярная концентрация эквивалента | C (1/z A) = n (1/z A) / V (A) = m (A) / M (1/z A) V (A) |
| Титр по определяемому веществу | T (Т/X) = T (Т) M (1/z X) / M (1/z Т) = c(1/z Т) M (1/z X)/1000 |
| Масса определяемого вещества | M (X) = C (1/z X) M (1/z X) VK |
| Содержание вещества в % | W (X), % = M (X) • 100% / m |
Меркуриметрическое титрование:
Сущность метода. Титрант. Условия проведения титрования. Определение конечной точки титрования. Расчёты: молярной концентрации эквивалента, титра по определяемому веществу, массы определяемого вещества и содержания вещества в %.
| Сущность метода | Используется для определения CL - Br – I- SCN- Hg2+. анализируемы раствор титруется раствором Hg(NO3)2 или Hg(CLO4)2. Образуются комплексы например Hg2+ 2CL- ® HgCL2 |
| Титрант | Стандартные растворы Hg(NO3)2 Hg(CLO4)2. 0,05 моль/л Которые готовят приблизительно а затем стандартизируют. |
| Условия проведения титрования. | Требует индикаторов. Очень осторожно, так как ртуть ядовита! |
| Определение конечной точки титрования. | В конечной точке титрования из-за взаимодействия индикатора нитропруссида натрия с ртутью образуется белый осадок или же при действии дифенилкарбазона синяя окраска раствора. |
| Молярная концентрация эквивалента | C (1/z A) = n (1/z A) / V (A) = m (A) / M (1/z A) V (A) |
| Титр по определяемому веществу | T (Hg2+/X) = T (Hg2+) M (1/z X) / M (1/z Hg2+) = c(1/z Hg2+) M (1/z X)/1000 |
| Масса определяемого вещества | M (X) = C (1/z X) M (1/z X) VK |
| Содержание вещества в % | W (X), % = M (X) • 100% / m |
Ацидиметрия:
Сущность метода. Титрант. Определение конечной точки титрования. Расчёты: молярной концентрации эквивалента, титра по определяемому веществу, массы определяемого вещества и содержания вещества в %.
| Сущность метода | Метод определения сильных и слабых оснований, солей слабых кислот, основных солей других соединений, обладающих основными свойствами, путем титрования стандартным раствором сильной кислоты. ОН- + Н3О+ ® 2 Н2О |
| Титрант | Растворы сильных кислот |
| Определение конечной точки титрования. | По изменению окраски различных индикаторов |
| Молярная концентрация эквивалента | C (1/z A) = n (1/z A) / V (A) = m (A) / M (1/z A) V (A) |
| Титр по определяемому веществу | T (Т/X) = T (Т) M (1/z X) / M (1/z Т) = c(1/z Т) M (1/z X)/1000 |
| Масса определяемого вещества | M (X) = C (1/z X) M (1/z X) VK |
| Содержание вещества в % | W (X), % = M (X) • 100% / m |
Аргентометрическое титрование
Метод Фольгарда. Сущность метода. Титрант. Условия проведения титрования. Определение конечной точки титрования. Расчёты: молярной концентрации эквивалента, титра по определяемому веществу, массы определяемого вещества и содержания вещества в %.
| Сущность метода | Осадительное титрование, использующее раствор AgNO3 В основе лижет реакция: Х- + Ag+ ® AgХ¯ В данном методе используется обратимое титрование избытка катионов серебра раствором NH4NCS. |
| Титрант | Раствор AgNO3 0,1 моль/л |
| Условия проведения титрования. | К раствору прибавляется точно известное избыточное количество раствора нитрата серебра и индикатор, и после перемешивания титруют не вступившие в реакцию катионы серебра раствором NH4NCS до розовой окраски раствора. Позволяет проводить титрование в сильно кислой среде. |
| Определение конечной точки титрования. | Появлении розовой окраски раствора в присутствии квасцов как индикатора. |
| Молярная концентрация эквивалента | C (1/z A) = n (1/z A) / V (A) = m (A) / M (1/z A) V (A) |
| Титр по определяемому веществу | T (Т/X) = T (Т) M (1/z X) / M (1/z Т) = c(1/z Т) M (1/z X)/1000 |
| Масса определяемого вещества | M (X) = C (1/z X) M (1/z X) VK |
| Содержание вещества в % | W (X), % = M (X) • 100% / m |
Йодатометрическое титрование:
Сущность метода. Титрант. Условия проведения титрования. Определение конечной точки титрования. Расчёты: молярной концентрации эквивалента, титра по определяемому веществу, массы определяемого вещества и содержания вещества в %.
| Сущность метода | В основе метода лежит полуреакция IO3- + 6e- + 6H+ ® I- + 3H2O Е0 = 1,08 В фактор эквивалентности равен = 1/6 При некоторых других условиях может пройти и другая реакция: IO3- + 5e- + 6H+ ® 0,5I2- + 3H2O Е0 = 1,195 |
| Титрант | KIO3 0,1 моль/л. |
| Условия проведения титрования. | Обратное титрование до изменения окраски индикатора из-за йода. |
| Определение конечной точки титрования. | Используется индикаторы крахмал или хлороформ, тетрахлорид углерода или красители. |
| Молярная концентрация эквивалента | C (1/z A) = n (1/z A) / V (A) = m (A) / M (1/z A) V (A) |
| Титр по определяемому веществу | T (Т/X) = T (Т) M (1/z X) / M (1/z Т) = c(1/z Т) M (1/z X)/1000 |
| Масса определяемого вещества | M (X) = C (1/z X) M (1/z X) VK |
| Содержание вещества в % | W (X), % = M (X) • 100% / m |
Перманганатометрическое титрование:
Сущность метода. Титрант. Условия проведения титрования. Определение конечной точки титрования. Расчёты: молярной концентрации эквивалента, титра по определяемому веществу, массы определяемого вещества и содержания вещества в %.
| Сущность метода | Так как KMnO4 сильный окислитель, то в зависимости от рН раствора он ведёт себя по разному: В сильнокислой: MnO4- + 5 e- ® Mn2+ + 4 H2O Е0 = 1,51 В В нейтральной: MnO4- + 3 e- ® MnO2 + 4 OH- Е0 = 0,60 B В сильнощелочной: MnO4- + e- ® MnO42- Е0 = 0,56 B | |
| Титрант | KMnO4 0,1 моль/л. | |
| Условия проведения титрования. | Наиболее целесообразно проведение в сильнокислых средах с серной кислотой, при комнатной температуре, без индикатора. | |
| Определение конечной точки титрования. | Избыточная капля раствора окрашивает в розовый цвет. | |
| Молярная концентрация эквивалента | C (1/z A) = n (1/z A) / V (A) = m (A) / M (1/z A) V (A) | |
| Титр по определяемому веществу | T (Т/X) = T (Т) M (1/z X) / M (1/z Т) = c(1/z Т) M (1/z X)/1000 | |
| Масса определяемого вещества | M (X) = C (1/z X) M (1/z X) VK | |
| Содержание вещества в % | W (X), % = M (X) • 100% / m | |
| ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ | ||
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Например, рассмотрим следующую реакцию:
H3PO4 + 2KOH ® K2HPO4 + 2H2O.
В ходе этой реакции только два атома водорода замещаются на атомы калия, иначе, в реакцию вступают два иона Н+ (кислота проявляет основность 2). Тогда по определению эквивалентом H3PO4 будет являться условная частица 1/2H3PO4, т.к. если одна молекула H3PO4 предоставляет два иона Н+, то один ион Н+ дает половина молекулы H3PO4.
С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает два иона ОН–, следовательно, один ион ОН– потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом кислоты является условная частица 1/2Н3РО4, а эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности (fЭ). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Формулы расчета фактора эквивалентности приведены в таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1. Между H3PO4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности: H3PO4 + 3KOH ® K3PO4 + 3H2O fЭ(H3PO4) = 1/3 H3PO4 + KOH ® KН2PO4 + H2O fЭ(H3PO4) = 1. Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть. |
Таблица 1.1 – Расчет фактора эквивалентности
| Частица | Фактор эквивалентности | Примеры |
| Элемент |  ,
где В(Э) – валентность элемента ,
где В(Э) – валентность элемента
| 

|
| Простое вещество |  ,
где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента ,
где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента
| fЭ(H2) = 1/(2×1) = 1/2; fЭ(O2) = 1/(2×2) = 1/4; fЭ(Cl2) = 1/(2×1) = 1/2; fЭ(O3) = 1/(3×2) = 1/6 |
| Оксид |  ,
где n(Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента ,
где n(Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента
| fЭ(Cr2O3) = 1/(2×3) = 1/6; fЭ(CrO) = 1/(1×2) = 1/2; fЭ(H2O) = 1/(2×1) = 1/2; fЭ(P2O5) = 1/(2×5) = 1/10 |
| Кислота |  ,
где n(H+) – число отданных в ходе реакции ионов водорода (основность кислоты) ,
где n(H+) – число отданных в ходе реакции ионов водорода (основность кислоты)
| fЭ(H2SO4) = 1/1 = 1 (основность равна 1) или fЭ(H2SO4) = 1/2 (основность равна 2) |
| Основание |  ,
где n(ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания) ,
где n(ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания)
| fЭ(Cu(OH)2) = 1/1 = 1 (кислотность равна 1) или fЭ(Cu(OH)2) = 1/2 (кислотность равна 2) |
| Соль |  ,
где n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка ,
где n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка
| fЭ(Cr2(SO4)3) = 1/(2×3) = 1/6 (расчет по металлу) или fЭ(Cr2(SO4)3) = 1/(3×2) = 1/6 (расчет по кислотному остатку) |
| Частица в окислительно-восстановительных реакциях |  ,
где ,
где  – число электронов, участвующих в процессе окисления или восстановления – число электронов, участвующих в процессе окисления или восстановления
| Fe2+ + 2  ® Fe0
fЭ(Fe2+) =1/2;
MnO4– + 8H+ + 5 ® Fe0
fЭ(Fe2+) =1/2;
MnO4– + 8H+ + 5  ® ® Mn2+ + 4H2O
fЭ(MnO4–) = 1/5 ® ® Mn2+ + 4H2O
fЭ(MnO4–) = 1/5
|
| Ион |  ,
где z – заряд иона ,
где z – заряд иона
| fЭ(SO42–) = 1/2 |
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl2, б) КНСО3, в) (MgOH)2SO4.
Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1.
а) ZnCl2 (средняя соль):
 .
.
fЭ(ZnCl2) = 1/2, поэтому эквивалентом ZnCl2 является частица 1/2ZnCl2.
б) КНСО3 (кислая соль):
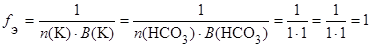 .
.
fЭ(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3.
в) (MgOH)2SO4 (основная соль):
 .
.
fЭ( (MgOH)2SO4 ) = 1/2, поэтому эквивалентом (MgOH)2SO4 является частица 1/2(MgOH)2SO4.
Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества nэ. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
| МЭ = М×fЭ. |
Молярная масса эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей, например:
| МЭ(оксида) = МЭ(элемента) + МЭ(О) = МЭ(элемента) + 8 МЭ(кислоты) = МЭ(Н) + МЭ(кислотного остатка) = 1 + МЭ(кислотного остатка) МЭ(основания) = МЭ(Ме) + МЭ(ОН) = МЭ(Ме) + 17 МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка). |
Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента( или VЭ)– объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента. Размерность «л/моль». При н.у. получаем:
или VЭ)– объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента. Размерность «л/моль». При н.у. получаем:

|
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам. Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
| nэ(реагента1) = … = nэ(реагентаn) = nэ(продукта1) = … = nэ(продуктаn) |
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
 или или  или или  , ,
|
где m1 и m2 – массы реагентов и (или) продуктов реакции, г;
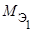 ,
, 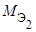 – молярные массы эквивалентов реагентов и (или) продуктов реакции, г/моль;
– молярные массы эквивалентов реагентов и (или) продуктов реакции, г/моль;
V1, V2 – объемы реагентов и (или) продуктов реакции, л;
 ,
,  – молярные объемы эквивалентов реагентов и (или) продуктов реакции, л/моль.
– молярные объемы эквивалентов реагентов и (или) продуктов реакции, л/моль.


