 |
Главная |
Глава 6. Способы выражения концентраций растворов
|
из
5.00
|
После изучения этой темы вы должны усвоить:
- основные понятия: раствор, растворитель, растворенное вещество;
- способы выражения концентраций растворов.
Растворыпредставляют собой гомогенную (однородную) систему, состоящую из двух или более компонентов и продуктов их взаимодействия. Растворителемсчитают тот компонент, количество которого в растворе преобладает.
Концентрацией раствора называется содержание растворенного вещества в определенной массе или определенном объеме раствора (или растворителя). Существует несколько способов выражения концентрации раствора: процентная концентрация, молярная, моляльная, нормальная, т.е. концентрация моль-эквивалентов.
Процентная концентрация(w) раствора показывает, сколько граммов растворенного вещества содержится в 100 г раствора. Математическое выражение для расчета процентной концентрации раствора:

Растворы характеризуются еще одной важной величиной – плотностью раствора. Плотность (r) – это масса одной единицы объема. Плотность обычно измеряют в г/см3 или г/мл.
Молярная концентрация (См) – показывает число молей растворенного вещества, содержащихся в 1 литре раствора.
1 Моль это такое количество вещества (n), которое содержит 6,02.1023 структурных единиц (атомов, молекул, ионов). 6,02 1023- число Авогадро. Молярная масса (М) вещества (масса одного моля) численно равна молекулярной массе.Она рассчитываетсякак отношение массы вещества (m) к его количеству: М = m/n (г/моль).
Моляльная концентрация (Cm) – показывает число молей растворенного вещества содержащихся в 1000 г растворителя.
Вещества вступают в реакции в эквивалентном количестве. Например, 1 моль H2SO4 эквивалентен 2 молям NaOH в реакции
H2SO4 + 2NaOH = Na2SO4 + 2H2O
Нормальная концентрация (Сн) – показывает число моль-эквивалентов растворенного вещества, содержащегося в 1 литре раствора.
Эквивалентом (Э) вещества (атом, молекула, ион)называют такое его количество, которое соединяется с 1молем атомов или ионов водорода или замещает то же количество атомов водорода в химической реакции. Масса одного эквивалента вещества выражается в граммах, называется эквивалентной массой. Для вычисления эквивалентной массы элемента его атомную массу (А) делят на валентность (В):
Эm(эл-та) = А\В , например ЭСа = 40\2 = 20 г/моль.экв.
Эквивалентные массы сложных веществ:
Эm(кислоты) = М\кол-во атомов Н
Эm(основания) = М\кол-во групп ОН
Эm(соль) = М \ В(Ме).n(Ме) , где n – число атомов металла в молекуле
В случае окислительно-восстановительных процессов молекулярную (атомную) массу вещества делят на число отданных или принятых электронов, например ЭmKMnO4 = M/5, если KMn+7O4  Mn+2.
Mn+2.
Закон эквивалентов. Массы реагирующих веществ прямопропорциональны их эквивалентным массам: m1\m2= Эm1\Эm2
Примеры расчета
Задача 1. Провести расчет массы кристаллогидрата СuSO4.5H2O и объем воды для приготовления 500 г раствора с wCuSO4 5% (r=1,1г/cм3).
 Þ m (безводного в-ва) =
Þ m (безводного в-ва) =  =
= 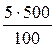 = 25г CuSO4 (безводного в-ва)
= 25г CuSO4 (безводного в-ва)
Расчет массы кристаллогидрата СuSO4.5H2O:
1 моль СuSO4.5H2O – 250г
1 моль СuSO4. – 160г Þ составим пропорцию:
160г безводного СuSO4.содержится в 250г СuSO4.5H2O
25г---------//------------//------------//-------х г-
х =  = 39,06 г СuSO4.5H2O
= 39,06 г СuSO4.5H2O
Расчет объема воды:
VH2O = mH2O . rH2O (rH2O = 1);
mH2O = mр-ра – mв-ва= 500 – 39,06 = 460,94 г или » 461мл.
Ответ: Для приготовления 5% раствора из кристаллогидрата (СuSO4.5H2O) берем навеску вещества 39,06г и растворяем в 461мл воды.
Задача 2. Из данного раствора приготовить 200 мл 0,1 молярного раствора.
Рассчитаем массу СuSO4.соответствующую концентрации См = 0,1 моль/л на объем колбы 200 мл:
0,1моль/л соответствует m = nМ = 0,1.160 = 16 г/л СuSO4
16 г СuSO4 содержится в 1000 мл раствора
х г //------- //------- //------ //--- 200 мл
х =  =3,2 г.
=3,2 г.
Найдем объем (V) 5% раствора, который содержит массу 3,2 г СuSO4:
|
 5% из определения процентной концентрации это 5 г – 100г (р-ра).
5% из определения процентной концентрации это 5 г – 100г (р-ра).
Vр-ра =  =
=  = 90,91мл
= 90,91мл
5г СuSO4 содержится в 90,91 мл раствора
3,2 г -----// -------//------//--- х мл
х =  = 58,18 мл » 58 мл.
= 58,18 мл » 58 мл.
Ответ: Для приготовления 0,1 молярного раствора на объем колбы 200 мл берем мерным цилиндром 58 мл (5% раствора СuSO4) и доводим раствор до метки водой.
Задача 3. Провести расчет нормальной концентрации данного 5% раствора СuSO4.
Найдем число моль эквивалентов 5% раствора:
Масса одного моля эквивалента равна Эm =  г
г
1моль эквивалент СuSO4 содержит 80 г
х моль эквивалент //------ // ----- //-----// -5 г (5%)
х =  = 0,06 моль-.экв./100г р-ра или 0,06моль.-экв./ 90,91 мл (см. выше)
= 0,06 моль-.экв./100г р-ра или 0,06моль.-экв./ 90,91 мл (см. выше)
0,06 моль эквивалентов содержится в 90,91 мл раствора
х (Сн) //------// -----// -----// ------// ----- 1000мл
х =  = 0,66 моль·экв/л
= 0,66 моль·экв/л
Ответ: Данный 5% раствор СuSO4 соответствует Сн =0,66 моль·экв/л.
Рекомендуемая литература: [1], с.216-221
|
из
5.00
|
Обсуждение в статье: Глава 6. Способы выражения концентраций растворов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

