 |
Главная |
Исключение грубых промахов
|
из
5.00
|
Некоторые из результатов единичных определений (вариант), входящих в выборочную совокупность, могут заметно отличаться от величин остальных вариант и вызывать сомнения в их достоверности. Для того чтобы статистическая обработка результатов количественного анализа была достоверной, выборка должна быть однородной,т. е. она не должна быть отягощена сомнительными вариантами - так называемыми грубыми промахами.Эти грубые промахи необходимо исключить из общего объема выборки, после чего можно проводить окончательное вычисление статистических характеристик.
Если объем выборки не велик 5≤ n <10, где n – число измерений массы бария xi (i=1…n), то исключение грубых промахов проводят с помощью Q-критерия. Для этого величины xi располагают в порядке возрастания их численного значения от xi до xn, где n – объем выборки, т.е. представляют в виде упорядоченной выборки. Затем для крайних величин - минимальной x1 и максимальной xn – вычисляют величину Q по формуле:
 | |||||
 | |||||
 | |||||
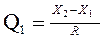
где R – размах варьирования, т. е. разность между максимальным Xn и минимальным X1 значениями вариант, составляющих выборку.
Рассчитанные значения Q1 и Qn сравнивают с табличными при заданных n и доверительной вероятности P. Если рассчитанные значения Q1 или Qn (или оба) оказываются больше табличных Q1 > Qтабл или Qn > Qтабл, то варианты Х1 или Хn (или обе) считаются грубыми промахами и исключаются из выборки.
Для получения выборки меньшего объёма проводят аналогичные расчеты до тех пор, пока не будут исключены все грубые промахи, так что окончательная выборка окажется однородной и не будет отягощена грубыми промахами.
В таблице приведены численные величины контрольного критерия Q для P = 0,90 - 0,99 и n = 3-10.
Таблица 1. Численные значения Q-критерия при доверительной вероятности Р и объёме выборки n.
| n p |  3 3
| |||||||
| 0,90 | 0,94 | 0,76 | 0,64 | 0,56 | 0,51 | 0,47 | 0,44 | 0,41 |
| 0,95 | 0,98 | 0,85 | 0,73 | 0,64 | 0,59 | 0,54 | 0,51 | 0,48 |
| 0,99 | 0,99 | 0,93 | 0,82 | 0,74 | 0,68 | 0,63 | 0,60 | 0,57 |
Примечание. В некоторых источниках числовые значения отличаются от величин, представленных в таблице.
При проведении Q-теста доверительную вероятность чаще всего принимают равной Р = 0,90 или 90%.
Если из двух крайних вариант Х1 и Хn только одна вызывает сомнение, то Q-тест можно проводить лишь в отношении этой сомнительной варианты.

 Рассчитаем среднее значение
Рассчитаем среднее значение 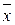 , отклонение di:
, отклонение di:

Стандартное отклонение s рассчитывается как корень квадратный из дисперсии V. Дисперсия показывает рассеяние определяемых величин относительно среднего и характеризует воспроизводимость анализа. Определяем квадрат отклонения и дисперсию по формулам:
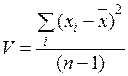 | |||
 | |||
;
 Доверительный интервал – интервал, в котором с заданной доверите-льной вероятностью Р находится действительное значение определяемой величины:
Доверительный интервал – интервал, в котором с заданной доверите-льной вероятностью Р находится действительное значение определяемой величины:
Рассчитываем относительную ошибку по формуле:
 |
Составляем итоговую таблицу, представляющую результаты анализа.
| xi | |
| n | |
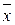
| |
| s | |

| |

|
III. Литература.
1. Ю.Я. Харитонов. Аналитическая химия ч. 2. Количественный анализ. Высшая школа. М., 2008 г., с. 12-17, 500-512.
2. В.П. Васильев. Аналитическая химия. Книга 1. Титриметрические и гравиметрический методы анализа. Высшее образование. М., 2004 г. С. 40-56.
3. Ю.Я. Золотов. Основы аналитической химии. Практическое руководство. Высшая школа, М., 2001 г. С. 188-198.
4. Лекции.
Вопросы контрольной работы по аналитической химии для студентов фармацевтического факультета
1. Основные понятия аналитической химии (метод анализа, методика анализа, виды анализа). Применение методов аналитической химии в фармации.
2. Аналитические признаки веществ и аналитические реакции (типы аналитических реакций и реагентов, характеристика чувствительности аналитических реакций).
3. Подготовка образца к анализу (средняя проба, масса пробы, растворение пробы и ее обработка насыщенными растворами соды, поташа или сплавлением с солями).
4. Качественный анализ. Классификация методов качественного анализа. Кислотно – основная классификация катионов по группам.
5. Сильные и слабые электролиты.
6. Общая концентрация и активность ионов в растворе. Ионная сила (ионная крепость) раствора. Влияние ионной силы раствора на коэффициент активности ионов.
7. Химическое равновесие. Константа химического равновесия (истинно термодинамическая, концентрационная, условная).
8. Гетерогенные равновесия в аналитической химии. Способы выражения растворимости малорастворимых электролитов.
9. Произведение растворимости малорастворимого сильного электролита. Условия образования осадков малорастворимых сильных электролитов.
10. Дробное осаждение и дробное растворение осадков. Перевод одних малорастворимых электролитов в другие.
11. Влияние различных факторов на полноту осаждения осадков и их растворение.
12. Влияние посторонних электролитов (влияние добавок электролита с одноименным ионом, влияние добавок постороннего индифферентного электролита).
13. Протолитическая теория кислот и оснований. Протолитические равновесия в воде.
14. Характеристика силы слабых кислот и оснований, их константы кислотности и основности и рН растворов.
15. Гидролиз (реакции гидролиза различных солей). Константы и степень гидролиза.
16. Вычисление значений рН растворов солей, подвергающихся гидролизу.
17. Буферные системы (растворы) (определение, классификация, примеры).
18. Значение рН буферных растворов, содержащих: а) слабую кислоту и ее соль; б) слабое основание и ее соль.
19. Буферная емкость. Использование буферных систем в анализе.
20. Окислительно – восстановительная система. Значение ОВР в химическом анализе.
21. Окислительно – восстановительные потенциалы редокс – пар: а) редокс потенциалы; б) электродные окислительно – восстановительные потенциалы.
22. Потенциалы (ЭДС) реакции (вывод для различных ОВР).
23. Направление протекания ОВР и глубина протекания ОВР. Влияние различных факторов на глубину протекания ОВР.
24. Изменения окислительно – восстановительных потенциалов редокс – систем под слиянием различных факторов (концентрации, рН, t, р, индифферентных ионов).
25. Общая характеристика комплексных (координационных) соединений металлов (комплексообразователь, лиганды, координационные числа, внутренняя и внешняя среды).
26. Общая характеристика комплексных соединений. Константы устойчивости и константы нестойкости соединений. Условные константы устойчивости комплексов.
27. Влияние различных факторов на процессы комплексообразования в растворах.
28. Типы комплексных соединений, применяемых в аналитике.
29. Применение комплексных соединений в химическом анализе:
а) осаждение катионов и анионов из растворов;
б) растворение осадков;
в) открытие и разделение ионов;
г) концентрирования веществ.
30. Реакции, основанные на образовании комплексных соединений металлов с органическими реагентами функциональные аналитические группы (ФАГ) и аналитико – активные группы (ААГ).
31. Основные критерии и основные органические реагенты, применяемые в реакциях, основанных на образовании комплексных соединений металлов.
32. Реакции без участия комплексных соединений металлов: образование окрашенных соединений с открываемыми веществами, образование органических соединений, обладающих специфическими свойствами.
33. Применение комплексных соединений в химическом анализе: определения подлинности лекарственных препаратов по функциональным группам; маскирования ионов в растворе.
34. Основные понятия (разделение, концентрирование, коэффициент (фактор) концентрирования).
35. Применение экстракции в аналитической химии. Жидкостная экстракция (принцип метода и основные понятия).
36. Экстракционное равновесие. Закон разделения Нернста – Шилова. Константа распределения. Коэффициент разделения. Фактор разделения двух веществ. Условия разделения веществ.
37. Влияние различных факторов на процессы экстракции (объем экстрагента, число экстракций, рН среды, маскирующих агентов).
38. Сущность метода хроматографии. Классификация хроматографических методов анализа: (по механизму разделения веществ; по агрегатному состоянию фаз, по технике эксперимента, по способу перемещения фаз).
39. Тонкослойная хроматография (ТСХ): (степень и коэффициент разделения; материалы и растворители в методе ТСХ).
40. Тонкослойная хроматография (ТСХ): (техника эксперимента).
41. Распределительная хроматография. Бумажная хроматография.
42. Осадочная хроматография (сущность метода, классификация способов, хроматография на бумаге).
Аналитические реакции катионов и анионов
по кислотно – основной классификации.
43. Аналитические реакции катионов I группы по кислотно – основной классификации (Li+, Na+, K+, NH4+).
44. Аналитические реакции катионов II группы по кислотно – основной классификации (Ag+, Hg22+, Pb2+).
45. Аналитические реакции катионов III группы по кислотно – основной классификации (Са2+, Sr2+, Ва2+).
46. Аналитические реакции катионов IV группы по кислотно – основной классификации (Zn2+, Al3+, Sn2+, Sn4+, As3+, As5+, Cr3+).
47. Аналитические реакции катионов V группы по кислотно – основной классификации (Mg2+, Sb3+, Sb5+, Bi3+, Mn2+, Fe2+, Fe3+).
48. Аналитические реакции катионов VI группы по кислотно – основной классификации (Cu2+, Cd2+, Hg2+, Co2+, Ni2+).
49. Аналитические реакции анионов I группы по кислотно – основной классификации (SO42-, SO32-, S2O32-, С2O42-, CO32-, В4О72- (ВO2- ), PO43-, АsO43-, АsO33-, F-).
50. Аналитические реакции анионов II группы по кислотно – основной классификации (Cl-,Br-, I-, BrO3-, CN-, SCN-, S2-).
51. Аналитические реакции анионов III группы по кислотно – основной классификации (NO2-, NO3-, CH3COO-).
52. Источники ошибок количественного анализа. Правильность и воспроизводимость результатов количественного анализа. Классификация ошибок количественного анализа (систематические, случайные).
53. Систематическая ошибка, процентная систематическая ошибка (относительная величина систематической ошибки). Источники систематических ошибок (методические, инструментальные, индивидуальные).
54. Оптимальный объем выборки, среднее значение определяемой величины, отклонение, дисперсия среднего, стандартное отклонение (среднее квадратичное отклонение), относительное стандартное отклонение, доверительный интервал, полуширина доверительного интервала, доверительная вероятность, коэффициент нормированных отклонений (коэффициент Стьюдента), относительная (процентная) ошибка среднего результата.
55. Оценка правильности результатов количественного анализа (использование стандартных образцов, анализа исследуемого объекта другими методами, метод добавок и удвоения). Случайные ошибки.
56. Исключение грубых промахов. Представление результатов количественного анализа. Оценка методов анализа по правильности и воспроизводимости. Сравнение двух методов анализа по воспроизводимости (сравнение дисперсией).
57. Основное понятие о гравиметрическом анализе (сущность метода, достоинства и недостатки).
58. Классификация методов гравиметрии: а) метод осаждения; б) методы отгонки (прямой, косвенный).
59. Классификация методов гравиметрии: (методы выделения, термогравиметрические методы).
60. Метод осаждения. Основные этапы гравиметрического определения. Применение гравиметрического анализа.
61. Осаждаемая и гравиметрическая формы и требования к ним. Гравиметрический фактор и его расчет. Требования к осадителю и промывной жидкости.
62. Понятие о природе образования осадков. Условия образования кристаллических и аморфных осадков.
63. Сущность метода кислотно – основного титрования. Типы кислотно – основного титрования. Основные реакции и титранты метода.
64. Индикаторы метода кислотно-основного титрования. Требования, предъявляемые к ним.
65. Ионная и хромофорная теории индикаторов при кислотно – основном титровании.
66. Ионно-хромофорная теории индикаторов при кислотно – основном титровании. Интервал перехода окраски индикатора.
67. Ошибки кислотно – основного титрования: (обусловленные физическими изменениями, индикаторные ошибки (водородная, гидроксидная, кислотная, основная), концентрационная, солевая).
68. Сущность метода окислительно – восстановительного титрования. Классификация редокс – методов. Условия проведения окислительно – восстановительного титрования. Требования к реакциям
69. Виды окислительно – восстановительного титрования (прямое, обратное, заместительное) и расчеты результатов титрования.
70. Индикаторы окислительно – восстановительного титрования: (их классификация, интервал изменения окраски, дифениламин, N-фенилантраниловая кислота, ферроин (достоинства и недостатки)).
71. Индикаторные ошибки окислительно-восстановительного титрования, их происхождение, расчет, значения.
72. Сущность метода перманганатометрии и его применения.
73. Условия проведения перманганатометрического титрования. Установления конечной точки титрования. Титрант, его приготовление, стандартизация.
74. Йодиметрическое титрование: (сущность метода, титрант (стандартный раствор йода) его приготовление, стандартизация, хранение, условия проведения титрования, определение конечной точки титрования (КТТ), применение.
75. Йодометрическое титрование: (сущность метода, титрант (стандартный раствор Na2S2O3) его приготовление, стандартизация, хранение, применение метода.
76. Йодатометрическое титрование: (сущность метода, титрант, его приготовление, стандартизация, условия проведения титрования, определение конечной точки титрования (КТТ), применение метода.
77. Дихроматометрическое титрование: (сущность метода, титрант, его приготовление, определение конечной точки титрования (КТТ), применение метода.
78. Хлорйодиметрическое титрование: (сущность метода, титрант, его приготовление, стандартизация, условия проведения титрования, применение метода).
79. Цериметрическое титрование: (сущность метода, титрант, его приготовление, стандартизация, применение метода).
80. Нитритометрическое титрование: (сущность метода, титрант, его приготовление, стандартизация, применение метода).
81. Броматометрическое титрование: (сущность метода, титрант (стандартный раствор йода), его приготовление, стандартизация, хранение, условия проведения титрования, определение конечной точки титрования (КТТ), применение метода).
82. Бромометрическое титрование: (сущность метода, титрант, его приготовление, применение метода).
83. Сущность метода комплексиметрии. Требования к реакциям в комплексиметрии. Классификация методов комплексиметрии.
84. Комплексонометрическое титрование: (понятие о комплексонах (комплексон I, II, III, IV), их особенности, понятие о комплексонах металлов)
85. Сущность метода комплексонометрического титрования. Состав и устойчивость комплексонатов металлов.
86. Индикаторы комплексонометрии: (принцип их действия, интервал изменения окраски индикатора, требования к индикаторам).
87. Титрант метода, его приготовление, стандартизация. Виды (примеры) комплексонометрического титрования (прямое, обратное, заместительное).
88. Ошибки метода, их происхождение, расчет, устранение. Применение комплексонометрии.
89. Меркуриметрическое титрование: (сущность метода, титрант, его приготовление, стандартизация, индикаторы метода, применение метода).
90. Сущность метода осадительного титрования. Требования к реакциям в методе осадительного титрования. Классификация методов. Виды осадительного титрования (прямое, обратное).
91. Индикаторы метода осадительного титрования, выбор их и условия применения.
92. Аргентрометрическое титрование (сущность метода, титрант, его приготовление и стандартизация, разновидности аргентометрии и применение).
93. Тиоцианометрическое титрование и сульфатометрическое титрование (сущность, титранты и применение этих методов).
94. Меркурометрическое титрование (сущность, титрант и индикаторы метода; достоинства и недостатки).
95. Общий принцип метода, классификация оптических методов анализа.
96. Молекулярный спектральный анализ в УФ и видимой области спектра (сущность метода спектр, и цвет; основные законы светопоглощения Бугера; объединенный закон светопоглощения Бугера – Ламберта – Беера – Бернара; коэффициент поглощения – молярный (e) и удельной (Е%), связь между молярным коэффициентом поглощения и коэффициентом поглощения света (К = 2,3 Е)
97. Молекулярный спектральный анализ в УФ и видимой области спектра: оптическая плотность (А) и светопропускание (Т), связь между ними; аддитивность оптической плотности, приведенная оптическая плотность; понятие о происхождении электронных спектров поглощения.
98. Колориметрия: метод стандартных серий; метод уравнивания красок, метод разбавления, применение этих методов в фармации.
99. Фотоколориметрия (сущность метода, достоинства и недостатки, применение).
100. Фотоэлектроколориметрия (сущность метода, достоинства и недостатки, применение).
101. Количественный фотометрический анализ: а) условия фотометрического определения; б) определение концентрации анализируемого раствора методом одного стандарта и методом добавок серий.
102. Количественный фотометрический анализ: (определение концентраций анализируемого раствора методом градуированного графика; определение концентраций нескольких веществ при их совместном присутствии).
103. Дифференциальный фотометрический анализ (сущность метода, способы определения концентраций).
104. Экстракционно – фотометрический анализ (сущность метода, условия проведения анализа, фотометрические реакции, применение метода).
105. Понятие о фотометрическом титровании.
106. Сущность метода люминесцентного анализа. Классификация различных видов люминесценцией.
107. Флуоресцентный анализ. Природа флуоресценции.
108. Основные характеристики и закономерности люминесценции (спектр, закон Стокса – Ломмеля, правило зеркальной симметрии Левшина, квантовый выход флуоресценции, закон С.И. Вавилова).
109. Количественный флуоресцентный анализ (принципы анализа, условия проведения, люминесцентная реакция).
110. Способы определения концентрации вещества с помощью флуоресцентного анализа: метод градуированного графика; метод одного стандарта. Применение флуоресцентного анализа.
111. Экстракционно – флуоресцентный анализ. Титрование с применением флуоресцентных индикаторов.
112. Сущность ионообменной хроматографии.
113. Иониты: их типы, строение, обменная емкость (статическая и динамическая), регенерация ионитов.
114. Ионообменное равновесие (константа ионного обмена, ее значение; коэффициент разделения ионов и коэффициент распределения).
115. Методы ионообменной хроматографии и ее применение.
116. Сущность метода ГЖХ. Практика метода.
117. Понятие о теории метода ГЖХ: параметры удерживания (время удерживания; время выхода; объем удерживания; коэффициент удерживания).
118. Понятие о теории метода ГЖХ: параметры разделения (степень разделения, коэффициент разделения, число теоретических тарелок). Влияние температуры на разделение.
119. Методы обработки хроматографии: (абсолютной калибровки; внутренней нормализации; внутреннего стандарта).
120. Комбинированные методы анализа: (хромато – масс – спектрометрия; хроматоспектро – фотометрия).
121. Жидкостная хроматография, высокоэффективная жидкостная хроматография: (сущность метода; применение в фармации).
122. Электрохимические методы анализа: (общие понятия; классификация).
123. Потенциометрия: (принцип метода; электроды, используемые в потенциометрии).
124. Определение концентрации раствора в прямой потенциометрии: (метод градуированного графика; метод стандартных добавок). Применение прямой потенциометрии.
125. Потенциометрическое титрование: (сущность метода; кривые титрования; применение).
126. Кондуктометрия: (принцип метода; основные понятия (удельное сопротивление, удельная, эквивалентная и молярная электропроводности; подвижность ионов)).
127. Прямая кондуктометрия. Определение концентрации раствора по методам: (расчетный; градуированного графика).
128. Кондуктометрическое титрование: (сущность метода; кривые титрования; высококачественное титрование (понятие); применение).
129. Принципы кулонометрического метода. Прямая кулонометрия: (сущность метода; электроды, применяемые в кулонометрии; способы определения количества электричества, прошедшего через раствор в прямой кулонометрии).
130. Кулонометрическое титрование: (сущность метода; условия проведения титрования; индикация точки эквивалентности в кулонометрическом титровании; применение метода).
131. Сущность полярографии. Общие понятия (электрические параметры, полярографическая ячейка, микрокатод и др.)
132. Количественный полярографический анализ. Определение концентрации анализируемого раствора методами градуировочного графика и стандартных растворов.
133. Условия проведения полярографии. Применение метода.
134. Сущность амперометрического титрования. Классификация методов. Условия проведения титрования.
135. Кривые титрования в амперометрии (их построение, типы, анализ, определение точки эквивалентности).
136. Амперометрическое титрование с двумя индикаторными электродами. Применение амперометрического титрования.
137. Ограничение возможностей методов титрования в водных растворах. Сущность метода кислотно-основного титрования в неводных средах.
138. Классификация растворителей, применяемых в неводном титровании (протонные, апротонные). Влияние природы растворителя на силу (кислотность, основность) растворенного протолита (нивелирующее и дифференцирующее действие растворителей, диэлектрическая проницаемость растворителя).
139. Полнота протекания реакций в неводных растворителях. Факторы, определяющие выбор протолитического растворителя.
140. Применение кислотно-основного титрования в неводных средах (определение слабых кислот, слабых оснований).
Варианты контрольных работ для студентов
|
из
5.00
|
Обсуждение в статье: Исключение грубых промахов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

