 |
Главная |
Спироароматические системы
|
из
5.00
|
Представитель — [4,2]спирарен. Подчиняется правилу Хюккеля.
Свойства
Как правило, ароматические соединения — твердые или жидкие вещества. Отличаются от алифатических и алициклических аналогов высокими показателями преломления и поглощения в близкой УФ и видимой области спектра. Для ароматических соединений характерны реакции замещения, как электрофильного(галогенирование, нитрование, сульфирование, алкилирование, ацилирование, др.), так и нуклеофильного (по различным механизмам). Возможны реакции присоединения, окисления (для моноядерных аренов — в весьма жестких условиях и/или с катализаторами).
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)
Типичными представителями ароматических углеводородов являются производные бензола, т.е. такие карбоциклические соединения, в молекулах которых имеется особая циклическая группировка из шести атомов углерода, называемая бензольным или ароматическим ядром.
Общая формула ароматических углеводородов CnH2n-6.
Строение бензола
Для изучения строения бензола необходимо просмотреть анимационный фильм "Строение бензола" (Данный видеоматериал доступен только на CD-ROM). Текст, сопровождающий этот фильм, в полном объеме перенесен в данный подраздел и ниже следует.
"В 1825 году английский исследователь Майкл Фарадей при термическом разложении ворвани выделил пахучее вещество, которое имело молекулярную формулу C6Н6. Это соединение, называемое теперь бензолом, является простейшим ароматическим углеводородом.
Распространенная структурная формула бензола, предложенная в 1865 году немецким ученым Кекуле, представляет собой цикл с чередующимися двойными и одинарными связями между углеродными атомами:

Однако физическими, химическими, а также квантово-механическими исследованиями установлено, что в молекуле бензола нет обычных двойных и одинарных углерод–углеродных связей. Все эти связи в нем равноценны, эквивалентны, т.е. являются как бы промежуточными "полуторными " связями, характерными только для бензольного ароматического ядра. Оказалось, кроме того, что в молекуле бензола все атомы углерода и водорода лежат в одной плоскости, причем атомы углерода находятся в вершинах правильного шестиугольника с одинаковой длиной связи между ними, равной 0,139 нм, и все валентные углы равны 120°. Такое расположение углеродного скелета связано с тем, что все атомы углерода в бензольном кольце имеют одинаковую электронную плотность и находятся в состоянии sp2 - гибридизации. Это означает, что у каждого атома углерода одна s- и две p- орбитали гибридизованы, а одна p- орбиталь негибридная. Три гибридных орбитали перекрываются: две из них с такими же орбиталями двух смежных углеродных атомов, а третья – с s- орбиталью атома водорода. Подобные перекрывания соответствующих орбиталей наблюдаются у всех атомов углерода бензольного кольца, в результате чего образуются двенадцать s- связей, расположенных в одной плоскости.
Четвертая негибридная гантелеобразная p- орбиталь атомов углерода расположена перпендикулярно плоскости направления s- связей. Она состоит из двух одинаковых долей, одна из которых лежит выше, а другая - ниже упомянутой плоскости. Каждая p- орбиталь занята одним электроном. р- Орбиталь одного атома углерода перекрывается сp- орбиталью соседнего атома углерода, что приводит, как и в случае этилена, к спариванию электронов и образованию дополнительной p- связи. Однако в случае бензола перекрывание не ограничивается только двумя орбиталями, как в этилене: р- орбиталь каждого атома углерода одинаково перекрывается с p- орбиталями двух смежных углеродных атомов. В результате образуются два непрерывных электронных облака в виде торов, одно из которых лежит выше, а другое – ниже плоскости атомов (тор – это пространственная фигура, имеющая форму бублика или спасательного круга). Иными словами, шесть р- электронов, взаимодействуя между собой, образуют единое p- электронное облако, которое изображается кружочком внутри шестичленного цикла:

С теоретической точки зрения ароматическими соединениями могут называться только такие циклические соединения, которые имеют плоское строение и содержат в замкнутой системе сопряжения (4n+2) p- электронов, где n – целое число. Приведенным критериям ароматичности, известным под названием правила Хюккеля, в полной мере отвечает бензол. Его число шесть p- электронов является числом Хюккеля для n=1, в связи с чем, шесть p- электронов молекулы бензола называют ароматическим секстетом".
Примером ароматических систем с 10 и 14 p- электронами являются представители многоядерных ароматических соединений –
нафталин  и
и
антрацен  .
.
Изомерия
Теория строения допускает существование только одного соединения с формулой бензола (C6H6) а также только одного ближайшего гомолога – толуола (C7H8). Однако последующие гомологи могут уже существовать в виде нескольких изомеров. Изомерия обусловлена изомерией углеродного скелета имеющихся радикалов и их взаимным положением в бензольном кольце. Положение двух заместителей указывают с помощью приставок: орто- (о-), если они находятся у соседних углеродных атомов (положение 1, 2-), мета- (м-) для разделенных одним атомом углерода (1, 3-) и пара- (п-) для находящихся напротив друг друга (1, 4-).
Например, для диметилбензола (ксилола):
орто-ксилол (1,2-диметилбензол) 
мета-ксилол (1,3-диметилбензол) 
пара-ксилол (1,4-диметилбензол) 
Получение
Известны следующие способы получения ароматических углеводородов.
1) Каталитическая дегидроциклизация алканов, т.е. отщепление водорода с одновременной циклизацией (способ Б.А.Казанского и А.Ф.Платэ). Реакция осуществляется при повышенной температуре с использованием катализатора, например оксида хрома.
 гептан гептан
| ––500°C® |  толуол толуол
| + 4H2 |
2) Каталитическое дегидрирование циклогексана и его производных (Н.Д.Зелинский). В качестве катализатора используется палладиевая чернь или платина при 300°C.
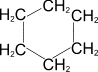 циклогексан циклогексан
| ––300°C,Pd® | 
| + 3H2 |
3) Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600°C (Н.Д.Зелинский).
| 3НCºСН | ––600°C® | 
|
4) Сплавление солей ароматических кислот со щелочью или натронной известью.

| + NaOH | ––t°® | 
| + Na2CO3 |
5) Алкилирование собственно бензола галогенопроизводными (реакция Фриделя-Крафтса) или олефинами.

| + CН3- | СН-Сl I CH3 | ––AlCl3® | 
| CH-CH3 I + HCl CH3 изопропил- бензол |

| + CН2=CН2 | ––H3PO4® | 
| CН2-CН3 этил- бензол |
Химические свойства
Бензольное ядро обладает высокой прочностью, чем и объясняется склонность ароматических углеводородов к реакциям замещения. В отличие от алканов, которые также склонны к реакциям замещения, ароматические углеводороды характеризуются большой подвижностью атомов водорода в ядре, поэтому реакции галогенирования, нитрования, сульфирования и др. протекают в значительно более мягких условиях, чем у алканов.
Электрофильное замещение в бензоле
Несмотря на то, что бензол по составу является ненасыщенным соединением, для него не характерны реакции присоединения. Типичными реакциями бензольного кольца являются реакции замещения атомов водорода – точнее говоря, реакции электрофильного замещения.
Рассмотрим примеры наиболее характерных реакций этого типа.
1) Галогенирование. При взаимодействии бензола с галогеном (в данном случае с хлором) атом водорода ядра замещается галогеном.
 + Cl2 –AlCl3®
+ Cl2 –AlCl3®  (хлорбензол) + H2O
(хлорбензол) + H2O
Реакции галогенирования осуществляются в присутствии катализатора, в качестве которого чаще всего используют хлориды алюминия или железа.
2) Нитрование. При действии на бензол нитрующей смеси атом водорода замещается нитрогруппой (нитрующая смесь – это смесь концентрированных азотной и серной кислот в соотношении 1:2 соответственно).
 + HNO3 –H2SO4®
+ HNO3 –H2SO4®  (нитробензол) + H2O
(нитробензол) + H2O
Серная кислота в данной реакции играет роль катализатора и водоотнимающего средства.
3) Сульфирование. Реакция сульфирования осуществляется концентрированной серной кислотой или олеумом (олеум – это раствор серного ангидрида в безводной серной кислоте). В процессе реакции водородный атом замещается сульфогруппой, приводя к моносульфокислоте.
 + H2SO4 –SO3®
+ H2SO4 –SO3®  (бензолсульфокислота) + H2O
(бензолсульфокислота) + H2O
4) Алкилирование (реакция Фриделя-Крафтса). При действии на бензол алкилгалогенидов в присутствии катализатора (хлористого алюминия) осуществляется замещение алкилом атома водорода бензольного ядра.
 + R–Cl –AlCl3®
+ R–Cl –AlCl3®  (R-углеводородный радикал) + HCl
(R-углеводородный радикал) + HCl
Следует отметить, что реакция алкилирования представляет собой общий способ получения гомологов бензола - алкилбензолов.
Рассмотрим механизм реакции электрофильного замещения в ряду бензола на примере реакции хлорирования.
Первичной стадией является генерирование электрофильной частицы. Она образуется в результате гетеролитического расщепления ковалентной связи в молекуле галогена под действием катализатора и представляет собой хлорид-катион.
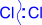
| + AlCl3 ® Cl+ + AlCl4- |
Образующаяся электрофильная частица атакует бензольное ядро, приводя к быстрому образованию нестойкого p- комплекса, в котором электрофильная частица притягивается к электронному облаку бензольного кольца.

| + Cl+ ® | 
| Cl+ |
| p- комплекс |
Иными словами, p- комплекс – это простое электростатическое взаимодействие электрофила и p- электронного облака ароматического ядра.
Далее происходит переход p- комплекса в s- комплекс, образование которого является наиболее важной стадией реакции. Электрофильная частица "захватывает" два электрона s- электронного секстета и образует s- связь с одним из атомов углерода бензольного кольца.

| Cl+ ® |  s- комплекс
s- комплекс
|
s- Комплекс – это катион, лишенный ароматической структуры, с четырьмя p- электронами, делокализованными (иначе говоря, распределенными) в сфере воздействия ядер пяти углеродных атомов. Шестой атом углерода меняет гибридное состояние своей электронной оболочки от sp2- до sp3-, выходит из плоскости кольца и приобретает тетраэдрическую симметрию. Оба заместителя – атомы водорода и хлора располагаются в плоскости, перпендикулярной к плоскости кольца.
На заключительной стадии реакции происходит отщепление протона от s- комплекса и ароматическая система восстанавливается, поскольку недостающая до ароматического секстета пара электронов возвращается в бензольное ядро.
 ®
®  + H+
+ H+
Отщепляющийся протон связывается с анионом четыреххлористого алюминия с образованием хлористого водорода и регенерацией хлорида алюминия.
H+ + AlCl4- ® HCl + AlCl3
Именно благодаря такой регенерации хлорида алюминия для начала реакции неоходимо очень небольшое (каталитическое) его количество.
Несмотря на склонность бензола к реакциям замещения, он в жестких условиях вступает и в реакции присоединения.
1) Гидрирование. Присоединение водорода осуществляется только в присутствии катализаторов и при повышенной температуре. Бензол гидрируется с образованием циклогексана, а производные бензола дают производные циклогексана.
 + 3H2 –t°,p,Ni®
+ 3H2 –t°,p,Ni®  (циклогексан)
(циклогексан)
2) На солнечном свету под воздействием ультрафиолетового излучения бензол присоединяет хлор и бром с образованием гексагалогенидов, которые при нагревании теряют три молекулы галогеноводорода и приводят к тригалогенбензолам.

| + 3Cl2 –hn® |  гексахлорциклогексан
гексахлорциклогексан
| 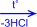
|  сим-трихлорбензол
сим-трихлорбензол
|
3) Окисление. Бензольное ядро более устойчиво к окислению, чем алканы. Даже перманганат калия, азотная кислота, пероксид водорода в обычных условиях на бензол не действуют. При действии же окислителей на гомологи бензола ближайший к ядру атом углерода боковой цепи окисляется до карбоксильной группы и дает ароматическую кислоту.
 + 2KMnO4 ®
+ 2KMnO4 ®  (калиевая соль бензойной кислоты) + 2MnO2 + KOH + H2O
(калиевая соль бензойной кислоты) + 2MnO2 + KOH + H2O
 + 4KMnO4 ®
+ 4KMnO4 ®  + K2CO3 + 4MnO2 + 2H2O + KOH
+ K2CO3 + 4MnO2 + 2H2O + KOH
Во всех случаях, как видно, независимо от длины боковой цепи образуется бензойная кислота.
При наличии в бензольном кольце нескольких заместителей можно окислить последовательно все имеющиеся цепи. Эта реакция применяется для установления строения ароматических углеводородов.
 –[O]®
–[O]®  (терефталевая кислота)
(терефталевая кислота)
Токсичность ароматических углеводородов — производных бензола при однократном в/ж введении крысам-самцам в дозе 5 мл/кг 76] [c.189]
Высокая химическая активность ароматических углеводородов, их способность к донорно-акцепторным взаимодействиям с полярными соединениями объясняет их большую, чем у других классов углеводородов, физиологическую активность и высокую токсичность. При этом ароматические углеводороды лучше растворимы в воде, чем другие углеводороды, легче образуют аэрозоли, эмульсии и суспензии. Большие масштабы производства и потребления ароматических углеводородов, их широкое использование в различных областях народного хозяйства делает особенно важными профилактические меры по зашите от неблагоприятных воздействий ароматических углеводородов.
Влияние на живые организмы
Тип воздействия ПАУ на живые организмы ключевым образом зависит от структуры самого углеводорода и может изменяться в очень широких пределах. Многие полициклические ароматические углеводороды являются сильными химическими канцерогенами. Такие соединения, как бенз[a]антрацен, бензпирен и овален, обладают ярко выраженными канцерогенными, мутагенными и тератогенными свойствами.
По оценкам 2002 года жители некоторых развитых стран получают с пищей, в среднем, около 1-5 мкг ПАУ ежедневно. При частом употреблении копченых продуктов или пищи, приготовленной на древесном угле (например, барбекю), суточное количество ПАУ может возрастать до 6-9 мкг. Еще около 0,16 мкг ПАУ в день (от 0,02 до 3 мкг) поступает в организм с наружным воздухом, и 0,006 мкг с питьевой водой (0,0002 - 0,12 мкг)[1].
Интенсивное развитие химической и обрабатывающей промышленности привело к интенсивному накоплению в природных биоценозах значительных количеств токсичных веществ, что, в свою очередь, обусловило развитие исследований в области охраны окружающей среды.
Полиароматические углеводороды (ПАУ) — органические соединения, для которых характерно наличие в химической структуре трех и более конденсированных бензольных колец. Основными источниками эмиссии техногенных ПАУ в окружающую природную среду являются предприятия энергетического комплекса, автомобильный транспорт, химическая и нефтеперерабатывающая промышленность. В основе практически всех техногенных источников ПАУ лежат термические процессы, связанные со сжиганием и переработкой органического сырья: нефтепродуктов, угля, древесины, мусора, пищи, табака и др.
Среди веществ-экотоксикантов полиароматические соединения занимают одно из первых мест по урону, наносимому окружающей среде. Спектр этих веществ чрезвычайно разнообразен. Их утилизация сводится в основном к захоронению на специальных полигонах. Токсичность, канцерогенность и мутагенность этих веществ общеизвестна.
Тип воздействия ПАУ на живые организмы ключевым образом зависит от структуры самого углеводорода и может изменяться в очень широких пределах. Многие полициклические ароматические углеводороды являются сильными химическими канцерогенами. Такие соединения, как бенз[a]антрацен, бензапирен и овален, обладают ярко выраженными канцерогенными, мутагенными и тератогенными свойствами.
|
из
5.00
|
Обсуждение в статье: Спироароматические системы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

