 |
Главная |
Уравнение состояния идеального газа
|
из
5.00
|
Уравнением состояния называется уравнение, связывающее три параметра: даврение p, объем V и температуру T. .
В 1834 г. французский физик Б. Клапейрон, работавший дли тельное время в Петербурге, вывел уравнение состояния идеального газа для постоянной массы газа. В 1874 г. Д. И.Менделеев вывел уравнение для произвольного числа молекул.
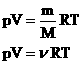 - уравнение состояния (уравнение Менделеева – Клапейрона).
- уравнение состояния (уравнение Менделеева – Клапейрона).
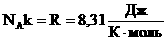 - универсальная газовая постоянная (универсальная, т.к. для всех газов одинаковая).
- универсальная газовая постоянная (универсальная, т.к. для всех газов одинаковая).
Часто необходимо исследовать ситуацию, когда меняется состояние газа при его неизменном количестве (m=const) и в отсутствие химических реакций (M=const). Это означает, что количество вещества υ=const. Тогда: 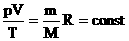 - уравнение Клапейрона.
- уравнение Клапейрона.
Для постоянной массы идеального газа отношение произведения давления на объем к абсолютной температуре в данном состоянии есть величина постоянная: 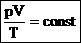
Газовые законы.
Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (p, V и T). Если процесс протекает достаточно медленно, то в любой момент система близка к своему равновесному состоянию. Такие процессы называются квазистатическими. В привычном для нас масштабе времени эти процессы могут протекать и не очень медленно. Например, разрежения и сжатия газа в звуковой волне, происходящие сотни раз в секунду, можно рассматривать как квазистатический процесс. Квазистатические процессы могут быть изображены на диаграмме состояний (например, в координатах p, V) в виде некоторой траектории, каждая точка которой представляет равновесное состояние.
Интерес представляют процессы, в которых один из параметров (p, V или T) остается неизменным. Такие процессы называются изопроцессами.
Количественные зависимости между двумя параметрами газа одной и той же массы при неизменном значении третьего параметра называют газовыми законами.
Процесс, протекающий при постоянной температуре (Т=const), называют изотермическим. Первый газовый закон был открыт английским ученым Р. Бойлем (1627- 1691 гг.) в 1600 г. Работа называлась «Новые эксперименты, касающиеся воздушной пружины». Бойль изучал изменение давления газа в зависимости от объема при постоянной температуре. Данный процесс называется изотермическим.
Независимо от Бойля несколько позднее французский ученый Э. Мариотт пришел к тем же выводам. Поэтому закон получил название Бойля-Мариотта. PV = const.
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным или изобарическим.
Объем данной массы газа при p = const зависит от температуры по линейному закону 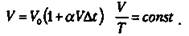 Это закон Гей-Люссака (1802 г.)
Это закон Гей-Люссака (1802 г.)
Изохорный или изохорический процесс – процесс, протекающий при постоянном объеме.
Закон Ж. Шарля (1787 г) При V = const давление данной массы газа при постоянном объеме зависит от температуры по линейному закону: 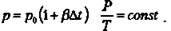
Экспериментально установленные законы Бойля–Мариотта, Шарля и Гей-Люссака находят объяснение в молекулярно-кинетической теории газов. Они являются следствием уравнения состояния идеального газа.
Насыщенный пар.
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом. Парообразование и конденсация являются примерами фазовых переходов.
Парообразованием называется фазовый переход из жидкого состояния в газообразное. Конденсация – это процесс, обратный процессу парообразования. При конденсации молекулы пара возвращаются в жидкость.
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Кипение.
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (т. е. давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В частности, при нормальном атмосферном давлении вода кипит при температуре 100 °С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на 1 °С на каждые 300 метров высоты). На высоте 7 км давление составляет примерно 0,4 атм, и температура кипения понижается до 70 С.
Влажность воздуха.
Влажность воздуха говорит о наличии водяного пара в атмосфере. При определении содержания влаги в воздухе используют понятия абсолютной и относительной влажности.
Абсолютная влажность ρа показывает, сколько граммов водяного пара содержится в воздухе объемом 1 м3 при данных условиях, т.е. плотность водяного пара, измеряемого в г/м3.
Атмосферный воздух представляет собой смесь различных газов и водяного пара. Каждый из газов вносит свой вклад в суммарное давление, производимое воздухом на находящиеся в нем тела.
Давление, которое производил бы водяной пар, если бы другие газы отсутствовали, называют парциальным давлением водяного пара (ра)
Парциальное давление водяного пара принимают за один из показателей влажности воздуха. Его выражают в единицах давления – паскалях или миллиметрах ртутного столба.
По парциальному давлению водяного пара и абсолютной влажности еще нельзя судить о том, насколько водяной пар в данных условиях близок к насыщению. А именно от этого зависит интенсивность испарения воды и потеря влаги живыми организмами. Поэтому вводят величину, которая показывает насколько водяной пар при данной температуре близок к насыщению., - относительную влажность.
Относительной влажностью воздуха называют отношение парциальное давление водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара при той же температуре, выраженное в процентах:
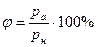 или
или 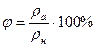 .
.
Относительная влажность воздуха обычно меньше 100%.
При понижении температуры парциальное давление паров воды в воздухе может стать равным давлению насыщенного пара. Пар начинает конденсироваться, и выпадает роса.
Температура, при которой водяной пар становится насыщенным, называется точкой росы.
Оптимальной относительной влажностью воздуха принято считать диапазон от 40 до 60%.
Приборы для определения влажности: психрометр, гигрометр.
|
из
5.00
|
Обсуждение в статье: Уравнение состояния идеального газа |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

