 |
Главная |
Электрический ток в жидкостях
|
из
5.00
|
Жидкости, как и твердые тела, могут быть проводниками, полупроводниками и диэлектриками. В этом уроке речь пойдет о жидкостях-проводниках. Причем не о жидкостях с электронной проводимостью (расплавленные металлы), а о жидкостях-проводниках второго рода (растворы и расплавы солей, кислот, оснований). Тип проводимости таких проводников – ионный. Проводники второго рода – такие проводники, в которых при протекании тока происходят химические процессы.

| Для лучшего понимания процесса проводимости тока в жидкостях, можно представить следующий опыт: В ванну с водой поместили два электрода, подключенные к источнику тока, в цепи в качестве индикатора тока можно взять лампочку. Если замкнуть такую цепь, лампа гореть не будет, что означает отсутствие тока, а это значит, что в цепи есть разрыв, и вода сама по себе ток не проводит. Но если в ванную поместить некоторое количество  – поваренной соли – и повторить замыкание, то лампочка загорится. Это значит, что в ванной между катодом и анодом начали двигаться свободные носители заряда, в данном случае ионы – поваренной соли – и повторить замыкание, то лампочка загорится. Это значит, что в ванной между катодом и анодом начали двигаться свободные носители заряда, в данном случае ионы
|
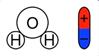 Полярность молекулы воды
Полярность молекулы воды
| Откуда во втором случае берутся свободные заряды? Как было сказано в одном из предыдущих уроков, некоторые диэлектрики – полярные. Вода имеет как раз-таки полярные молекулы |
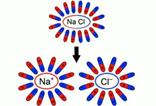 Схема образования свободных ионов
Схема образования свободных ионов
| При внесении в воду соли молекулы воды ориентируются таким образом, что их отрицательные полюса находятся возле натрия, положительные – возле хлора. В результате взаимодействий между зарядами молекулы воды разрывают молекулы соли на пары разноименных ионов. Ион натрия имеет положительный заряд, ион хлора – отрицательный. Именно эти ионы и будут двигаться между электродами под действием электрического поля. При подходе ионов натрия к катоду он получает свои недостающие электроны, ионы хлора при достижении анода отдают свои |
Так как протекание тока в жидкостях связано с переносом вещества, при таком токе имеет место процесс электролиза. Электролиз – процесс, связанный с окислительно-восстановительными реакциями, при которых на электродах выделяется вещество.
Вещества, которые в результате подобных расщеплений обеспечивают ионную проводимость, называются электролитами. Такое название предложил английский физик Майкл Фарадей.
 Майкл Фарадей
Майкл Фарадей
| Законы Фарадея:
1. Масса вещества, выделившегося на электродах прямо пропорциональна силе тока, идущего через электролит и времени прохождения тока.
 
 – электрохимический эквивалент. Это табличная величина, которая уникальна для каждого электролита и является его главной характеристикой. Размерность электрохимического эквивалента: – электрохимический эквивалент. Это табличная величина, которая уникальна для каждого электролита и является его главной характеристикой. Размерность электрохимического эквивалента:
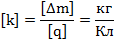 Физический смысл электрохимического эквивалента – масса, выделившаяся на электроде при прохождении через электролит количества электричества в 1 Кл.
2. Физический смысл электрохимического эквивалента – масса, выделившаяся на электроде при прохождении через электролит количества электричества в 1 Кл.
2.

 – молярная масса электролита; – молярная масса электролита; 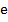 – элементарный заряд; – элементарный заряд;  – валентность электролита; – валентность электролита;  – число Авогадро. – число Авогадро.
|
Первое практическое применение электролиза произошло в 1838 году русским ученым Якоби. С помощью электролиза он получил оттиск фигур для Исаакиевского собора.
|
из
5.00
|
Обсуждение в статье: Электрический ток в жидкостях |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

