 |
Главная |
Для защиты металла от коррозии
|
из
5.00
|
применяют способы: Примеры:
| 1) химические; 2) физические; 3) электрохимические. | а) эмалирование; б) сульфатирование; в) гальванопокрытие; г) фосфотирование; д) смазка маслами; е) оксидирование; ж) покрытие лаками; з) ингибирование; и) легирование; к) покрытие полимерами; л) пассивирование; м) установление протекторов; н) катодная защита. 1- г, е, б 2- а, в, д, ж, з, и, к, л 3- н, м |
78. Вид коррозионных процессов: При контакте фаз:
| 1) химический: 2) электрохимический. | а) железо – разбавленная серная кислота; б) железо – концентрированная серная кислота; в) золото – пары йода; г) золото – влажный воздух. 1- г в 2- а б |
Алюминий склёпан медью
| Электроды: 1) анод; г) + а) Al. 2) катод.в) – б) Cu. | Металлы и заряды: |
Выберите правильный вариант ответа.
80.Покрытие анодное:
1) цинк – медью;
2) медь – алюминием;
3) медь – золото;
4) алюминий – серебром.
81.При нарушения покрытия во влажном воздухе химизм процесса на электродах
Анод
Fe → Fe2++ 2e
Происходит реакция окисления.
Катод
На катоде проходит реакция восстановления.
O2+ 2H2O + 4e → 4OH-(кислородная деполяризация в нейтральных, щелочных средах)
O2+ 4H++ 4e → 2H2O (кислородная деполяризация в кислых средах)
2 H++ 2e → H2(при водородной деполяризации).
Дополните:
82.Устройство для электролиза называется электролизер, в нем энергия электрическая, превращается в энергию химическую
83.Анод – электрод, на котором идет процесс окисления, имеет заряд положительный, подходят частицы отрицательные (анионы)
84.На катоде в первую очередь разряжаются частицы, j р которых имеет большее значение (более положителен)
85.Сила тока (Ja), необходимая для электролиза вычисляется по формуле …
Закон Фарадея: m = (M*I*t)/(n*F)
M - молекулярная масса металла, г/моль
I - сила тока, А
t - время, с
n - кол-во электронов, участвующих в процессе
F - число Фарадея, равно 96500 Кл.
Выражаем силу тока: I = (m*n*F)/(M*t)
86.На аноде разряжается кислотный остаток безкислородный
87.Электрод – «окислитель» это катод
88.Электролиз с растворимым анодом используется:
1) в гальванотехнике для покрытия одних металлов тонким слоем других
2) рафинирование (очищение) металлов
Установите соответствие:
| 89.В состав соли входит металл: 1) неактивный 2) средней активности 3) активный | На катоде выделяются: а) водород из воды б) металл в) металл и водород из воды. |
Б, 2- в, 3- а
При электролизе раствора соли
| На аноде разряжается: 1) кислотный остаток(An) 2) кислород из воды | Кислотный остаток- анион: а) карбонат б) хлорид в)нитрат г)сульфат д) бромид е) иодид 1- б, д, е 2- а, в, г, |
Выберите правильный вариант.
91.Из смеси катионов: Ag+, Cu2+, Fe2+, Zn2+ в первую очередь восстановятся катионы:
| 1.меди 2.железа | 3.цинка 4.серебра |
92.Для покрытия металла никелем электролиз ведут, используя:
| 1.К - никелевый 2.А - никелевый | 3.К - угольный 4.А - угольный |
93.При электролизе раствора хлорида натрия среда раствора у катода:
1) кислая
2) нейтральная
3) щелочная
94. Кальций можно получить из хлорида кальция путем:
1) электролиза раствора
2) электролиза расплава
3) восстановлением водорода
4) термического разложения.
95. При электролизе раствора хлорида меди ( анод медный ) на аноде окислится:
1) хлор
2) кислород
3) водород
4) медь
96.При электролизе раствора карбоната натрия с графитовыми электродами на аноде происходит:
1) выделение СО2
2) выделение кислорода
3) выделение водорода
4) осаждение натрия.
Часть В
Дайте полное решение заданий.
Составьте электронную формулу атомов железа, графически укажите валентные электроны в нормальном и возбужденном состояниях. Какие степени окисления может проявлять атом железа? Приведите примеры оксидов и гидроксидов железа в соответствующих степенях окисления, укажите их характер.
2. Если в момент химического равновесия 2NO + O2  2NO2 концентрации NO, O2 и NO2 соответственно равны 8 моль/л., 6 моль/л., 4 моль/л., то начальные концентрации исходных веществ (NO и O2) были:
2NO2 концентрации NO, O2 и NO2 соответственно равны 8 моль/л., 6 моль/л., 4 моль/л., то начальные концентрации исходных веществ (NO и O2) были:
1) 12 моль/л и 8 моль/л;
2) 14 моль/л и 8 моль/л;
3) 16 моль/л и 12 моль/л;
4)32 моль/л и 24 моль/л.
3. Окисление аммиака протекает по уравнению: 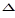 Н обр. 4NH3 + 3O2 = 2N2 + 6 H2O
Н обр. 4NH3 + 3O2 = 2N2 + 6 H2O 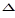 Н x.p. = -1528 кДж
Н x.p. = -1528 кДж
кДж/моль г г г ж (-285,84)
теплота образования аммиака ( 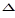 Н0 обр.(NH3)) равна:
Н0 обр.(NH3)) равна:
1) -92,15 кДж/моль;
2) 92,15 кДж/моль;
3) 46,76 кДж/моль;
4)-46,76 кДж/моль.
|
из
5.00
|
Обсуждение в статье: Для защиты металла от коррозии |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

