 |
Главная |
Реальные газы .критическое состояние вещества. Фазовое равновесие а фазовые превращения. Понятие фазы и физического равновесия
|
из
5.00
|
Самоорганизация в открытых системах вдали от теплового равновесия.
1. Для этого система должна быть открытой, потому что закрытая, изолированная система в соответствии со вторым законом термодинамики в конечном итоге должна придти в состояние; характеризуемое максимальным беспорядком или дезорганизацией.
2. Открытая система должна находиться достаточно далеко от точки термодинамического равновесия. Если система находится в точке равновесия, то она обладает максимальной энтропией и потому неспособна к какой-либо организации: в этом положении достигается максимум ее самодезорганизации. Если же система расположена вблизи или недалеко от точки равновесия, то со временем она приблизится к ней и в конце концов придет в состояние полной дезорганизации.
3. Если упорядочивающим принципом для изолированных систем является эволюция в сторону увеличения их энтропии или усиления их беспорядка (принцип Больцмана), то фундаментальным принципом самоорганизации служит, напротив, возникновение и усиление порядка через флуктуации. Такие флуктуации, или случайные отклонения системы от некоторого среднего положения, в самом начале подавляются и ликвидируются системой. Однако в открытых системах благодаря усилению неравновесности эти отклонения со временем возрастают и в конце концов приводят к "расшатыванию" прежнего порядка и возникновению нового порядка.
Этот процесс обычно характеризуют как принцип образования порядка через флуктуации. Поскольку флуктуации носят случайный характер (а именно: с них начинается возникновение нового порядка и структуры), то становится ясным, что появление нового в мире всегда связано с действием случайных факторов. В этом выводе находит свое конкретное подтверждение гениальная догадка античных философов Эпикура (341-270 до н. э.) и Лукреция Кара (99-45 до н. э.), требовавших допущения случайности для объяснения появления нового в развитии мира
Микроскопическая основа самоорганизации
Понятие о динамическом хаосе и фрактлах
Хаос – это беспорядок, перепутанность, образование, лишенное стройности системы. Это понятие выражает особое состояние какого-либо образования, характеризующееся отсутствием предсказуемости фаз изменения и развития, а также последствий протекаемых процессов. В античном мировоззрении хаос противопоставлялся Космосу – началу упорядоченному и гармоническому.
В науке, в частности в физике и математике, понятие хаоса связано с изменениями. Наиболее характерным примером хаоса в физике является броуновское движение молекул газа в воздухе. Молекулы находятся в непрерывном хаотическом движении, соударяясь случайно, они непредсказуемо меняют направление своего движения. Предсказать траекторию их движения практически невозможно. Такой вид хаоса называют недетерминированным или микроскопическим. Макроскопический хаос или детерминированный порождается не случайным поведением большого числа элементов системы, а внутренней сущностью нелинейных процессов. Простейший пример возникновения структуры за счет увеличения хаоса представляет собой двигатель внутреннего сгорания, в котором возникающая в холодильнике неупорядоченность в поведении газовых частиц превосходит упорядоченность, сообщенную поршню. Результатом совместных процессов, происходящих в нагревателе и холодильнике, становится разрушение структуры, поскольку энергия теряет свое качество при переходе от горячего тела к холодному. Однако конструкция двигателя такова, что в процессе диссипации энергии возникает определенная структура, которую и воспринимают частицы поршня. Эту структуру мы обычно называем работой.
реальные газы .критическое состояние вещества. Фазовое равновесие а фазовые превращения. Понятие фазы и физического равновесия
Реальные газы – газы, свойства которых зависят от взаимодействия молекул. В обычных условиях, когда средняя потенциальная энергия межмолекулярного взаимодействия много меньше средней кинетической энергии молекул, свойства реальных и идеальных газов отличаются незначительно. Поведение этих газов резко различно при высоких давлениях и низких температурах, когда начинают проявляться квантовые эффекты.
Ван–дер–Ваальс, объясняя свойства реальных газов и жидкостей, предположил, что на малых расстояниях между молекулами действуют силы
отталкивания, которые с увеличением расстояния сменяются силами притяжения. Межмолекулярные взаимодействия имеют электрическую природу и складываются из сил притяжения (ориентационных, индукционных) и сил отталкивания.
В модели идеального газа не учитывается собственный объем молекул и силы межмолекулярного взаимодействия. Тщательная экспериментальная проверка газовых законов (закон Бойля —Мариотта, закон Шарля, закон Гей-Люссака) современными методами показала, что эти законы достаточно точно описывают поведение реальных газов при небольших давлениях и высоких температурах
Учитывая собственный объем молекул и силы межмолекулярного взаимодействия голладский физик ванн дер вальс вывел уравнение состояние реального газа . ван дер ваальсом в уравнение клайперона менделеева введены две поправки.
1)наличие сил отталкивания которые противодействуют проникновению в занятой в молекул, сводится к тому что фактический свободный обем в котором могут двигаться молекулы реального газа будет не Vm а Vm – b ., где b- объем занимаемый самими молекулами. Объем b равен учетверенному собственному объему молекул.
2. учет притяжение молекул .действия сил притяжение газа приводит к появлению дополнительного давления на газ,называемого внутренним давление .. по вычислениям ванн дер вальса внутреннее давление обратно пропорциального квадрата молярного объема : p’= a/Vm^2 , где а- постоянная ванн дер вальса ,характеризующая силы межмолекулярного притяжения, Vm- молряный объем.
Вводя эти попровки получим уравнение ванн дер вальса для 1 моль газа ( уравнение состояния реальных газов):

Для произвольного количества вещества (ѵ=m/M) с учетом того что V=ѵVm, уравнение ванн дер вальса примет вид :

Где V-объем, a и b – постоянные для каждого газа величина , определяемые опытным путем.
Вывод уравнения:




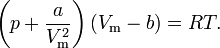
|
из
5.00
|
Обсуждение в статье: Реальные газы .критическое состояние вещества. Фазовое равновесие а фазовые превращения. Понятие фазы и физического равновесия |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

