 |
Главная |
Условия фазового равновесия
|
из
5.00
|
В наиболее общей форме условия фазового равновесия можно получить, исходя из первого и второго начал термодинамики. Второе начало термодинамики в формулировке Клаузиуса дает ключ для получения условий равновесия: при равновесии энтропия изолированной системы максимальна. Это означает, что все самопроизвольные процессы, протекающие в изолированной системе, сопровождаются увеличением энтропии. Например, диффузия атомов и химические реакции ведут к увеличению энтропии.
Рассмотрим вопрос о том, какое из возможных состояний системы отвечает термодинамическому равновесию, т. е. при отсутствии внешнего воздействия может существовать неограниченно долго. Для равновесия недостаточно, чтобы какой-либо термодинамический потенциал имел экстремальное значение. Принцип экстремальности применим только в том случае, когда сравниваемые состояния удовлетворяют определенным условиям: например, рассматриваются состояния изолированной системы или состояния с постоянной температурой и давлением.
В изолированной системе при равновесии экстремального значения достигает энтропия. Однако гораздо чаще процессы протекают не в изолированной системе, а при постоянной температуре. Рассмотрим условие изотермического равновесия. Для таких систем справедливо основное неравенство термодинамики для неравновесных процессов
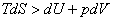 . .
| (13.8) |
Если рассматривать изотермические процессы, протекающие при постоянном объеме, и перейти к независимым переменным, объему и температуре (V и T), то уравнение (13.8) примет вид
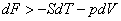 ; ; 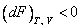 . .
| (13.9) |
Следовательно, в рассматриваемой системе с неизменным количеством вещества могут протекать лишь такие процессы, при которых свободная энергия Гельмгольца не растет. Они прекращаются, как только свободная энергия F достигает минимума, что соответствует термодинамическому равновесию системы. Таким образом, при постоянных температуре (T) и объеме (V) состоянию равновесия отвечает минимум свободной энергии Гельмгольца 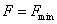 . Аналогично для энергии Гиббса (от p и T)
. Аналогично для энергии Гиббса (от p и T)
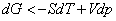 ; ; 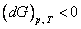 . .
| (13.10) |
В этом случае равновесному состоянию системы отвечает минимум термодинамического потенциала Гиббса 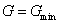 .
.
Найденные условия термодинамического равновесия позволяют выделить равновесное состояние среди других, но они ничего не говорят о возможных внутренних условиях, определяющих равновесие между компонентами системы.
Исследуем условия равновесия фаз, имеющих в общем случае различный химический состав. Зафиксируем опять температуру (T) и давление (p). Тогда для системы из двух фаз α и β должно выполняться требование минимума термодинамического потенциала. В состоянии равновесия имеем
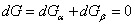 . .
| (13.11) |
Поскольку температура, давление и общее количество вещества неизменны, то изменения возможны только в отношении состава фаз, т. е. какое-то количество компонента K может перейти из одной фазы в другую. При этом число молей компонента K в фазах α и β: 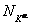 ,
, 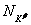 изменяется на величины
изменяется на величины 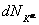 и
и 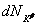 . Тогда
. Тогда 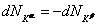 . В результате
. В результате
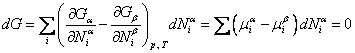 . .
| (13.12) |
Это условие должно выполняться для любого изменения количества вещества 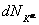 , для каждого компонента K, т. е.
, для каждого компонента K, т. е.
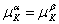 . .
| (13.13) |
Итак, при равновесии двух фаз химические потенциалы имеют одинаковую величину для каждого из компонентов, входящих в состав обеих фаз.
Рассмотрим равновесное состояние в многокомпонентной многофазной системе. Пусть фазы α и β находятся в равновесии друг с другом. В зависимости от природы межфазной границы возможны различные виды взаимодействия.
ПОВЕРХНОСТНО-АКТИВНЫЕВЕЩЕСТВА - (ПАВ) - вещества (как правило, органич. соединения), обладающие высокой поверхностной активностью, т. е. способностью адсорбироваться на межфазных границах и сильно снижать поверхностное натяжение. Мерой поверхностной активности может служить значение производной 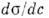 при с
при с 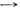 0, где
0, где 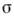 - поверхностное натяжение, с - объёмная концентрация ПАВ. В принципе любое вещество в определённых условиях может проявить поверхностную активность. В особый класс ПАВ выделяются вещества, имеющие высокую поверхностную активность на границах водного раствора. Ее обозначают через g и выражают в Дж•м/моль или Н•м2/моль:
- поверхностное натяжение, с - объёмная концентрация ПАВ. В принципе любое вещество в определённых условиях может проявить поверхностную активность. В особый класс ПАВ выделяются вещества, имеющие высокую поверхностную активность на границах водного раствора. Ее обозначают через g и выражают в Дж•м/моль или Н•м2/моль:
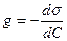 .
.
Важность характеристики g в том, что она пропорциональна адсорбционной способности вещества. В узких интервалах концентраций производную заменяют отношением конечных изменений:
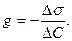
|
из
5.00
|
Обсуждение в статье: Условия фазового равновесия |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

