 |
Главная |
Фазовые равновесия и фазовые превращения
|
из
5.00
|
Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механического и химического равновесия.
Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковую температуру.
Механическое равновесие означает равенство давлений по разные стороны границы раздела соприкасающихся фаз. Строго говоря, в реальных системах эти давления равны лишь приближенно, разность давлений создается поверхностным натяжением.
Химическое равновесие выражается в равенстве химических потенциалов всех фаз вещества.
Рассмотрим химически однородную систему (состоящую из частиц одного типа). Пусть в этой системе имеется граница раздела между фазами 1 и 2. Как было указано выше, для равновесия фаз требуется равенство температур и давлений на границе раздела фаз. Известно (см. статью Термодинамические потенциалы), что состояние термодинамического равновесия в системе с постоянными температурой и давлением соответствует точке минимума потенциала Гиббса.
Потенциал Гиббса такой системы будет равен
-
 ,
,
где  и
и  — химические потенциалы, а
— химические потенциалы, а  и
и  — числа частиц в первой и второй фазах соответственно.
— числа частиц в первой и второй фазах соответственно.
При этом сумма 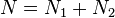 (полное число частиц в системе) меняться не может, поэтому можно записать
(полное число частиц в системе) меняться не может, поэтому можно записать
-
 .
.
Предположим, что  , для определенности,
, для определенности, 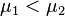 . Тогда, очевидно, минимум потенциала Гиббса достигается при
. Тогда, очевидно, минимум потенциала Гиббса достигается при 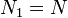 (все вещество перешло в первую фазу).
(все вещество перешло в первую фазу).
Таким образом, равновесие фаз возможно только в том случае, когда химические потенциалы этих фаз по разные стороны границы раздела равны:
-
 .
.
Из условия равновесия фаз можно получить зависимость давления в равновесной системе от температуры. Если говорить о равновесии жидкость — пар, то под давлением понимают давление насыщенных паров, а зависимость  называется кривой испарения.
называется кривой испарения.
Из условия равенства химических потенциалов следует условие равенства удельных термодинамических потенциалов:
-
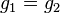 ,
,
где 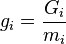 ,
,  — потенциал Гиббса i-й фазы,
— потенциал Гиббса i-й фазы, 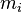 — её масса.
— её масса.
Отсюда:
-
 ,
,
а значит,
-
 ,
,
где  и
и  — удельные объем и энтропия фаз. Отсюда следует, что
— удельные объем и энтропия фаз. Отсюда следует, что
-
 ,
,
и окончательно
-
 ,
,
где  — удельная теплота фазового перехода (например, удельная теплота плавления или удельная теплота испарения).
— удельная теплота фазового перехода (например, удельная теплота плавления или удельная теплота испарения).
Последнее уравнение называется уравнением Клапейрона — Клаузиуса.
Переходы вещества из одной фазы в другую при изменении состояния системы называют фазовыми превращениями. Фаза — совокупность телесных объектов, имеющих определенный химический состав и термодинамические свойства, отделенная от других фаз поверхностью раздела. Или иначе: фаза — это однородная часть неоднородной системы, которая может быть выделена из системы каким‑либо механическим способом. Существует, как правило, одна газовая фаза (за исключением редких случаев расслоения газовых смесей при очень высоких давлениях). Число жидких и особенно твердых фаз может быть достаточно велико. Основная характеристика фазовых превращений — температура, при которой фазы находятся в состоянии термодинамического равновесия, — точка фазового перехода.
Фазой назывется термодинамическое равновесие состояния вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества . если например в закрытом сосуде находится вода то эта система является двухфазной : жидкая фаза – вода , газообразная фаза- смесь воздуха с водняными парами. Часто понятие фаза употребляется в смысле агрегатного состояния , однако надо учитывать что оно шире чем понятие агрегатного состяния. Переход вещества из одной фазы в другую фазовый переход всегда связан с качественными изменениями свойства вещества. Примером фазового перехода могут служить изменения агрегатного состояния вещества или переходы связанные с изменениями в составе строения и свойства вещества.
|
из
5.00
|
Обсуждение в статье: Фазовые равновесия и фазовые превращения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

