 |
Главная |
НАПРАВЛЕННОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
|
из
5.00
|
Важное место в этом разделе занимают функции состояния – энтропия (S) и энергия Гиббса. Энтропия является мерой неупорядоченности, мерой связанной, не превращаемой в работу энергии. Изменение энтропии ΔS > 0 является критерием самопроизвольности процессов при условии изолированности реакционной системы (Н = const, Т = const, P = const). В качестве критерия направленности химических процессов, протекающих в реальных, закрытых и открытых системах, используется изменение изобарно-изотермического потенциала (энергии Гиббса), DGТ, Р < 0 [1, 2, 5].
Пример 1. Определите, для какого вещества Н2О (ж) или Н2О (г) энтропия меньше.
Решение. Энтропия вещества зависит от его агрегатного состояния. Изменение энтропии в процессе испарения воды  , где
, где  – теплота испарения воды, Т – температура кипения. Так как
– теплота испарения воды, Т – температура кипения. Так как  > 0, то
> 0, то  > 0 – энтропия увеличивается при испарении:
> 0 – энтропия увеличивается при испарении:  ( Н2О (ж)) <
( Н2О (ж)) <  ( Н2О (г))
( Н2О (г))
Пример 2. Определите, не производя расчётов, как меняется энтропия в следующем процессе:
2 NH4Cl4 (к) ® N2 (г) + Cl2 (г) + 4 H2O (г) + 2O2 (г).
Решение. В данной реакции при разложении твердого вещества NН4СlO4 образуются газообразные N2 (г), Cl2 (г), Н2О (г) и О2 (г). Энтропия продуктов реакции S2 больше энтропии исходного вещества S1, поэтому  = S2 – S1 > 0 , т.е. энтропия при протекании реакции увеличивается.
= S2 – S1 > 0 , т.е. энтропия при протекании реакции увеличивается.
Пример 3. Рассчитайте  реакции:
реакции:
3Fе (к) + 4Н2О (г) = Fе3O4 (к) + 4Н2 (г).
Определите, увеличивается или уменьшается «беспорядок» в системе.
Решение. Энтропия, как и другие параметры системы (U, Н), является функцией состояния, т.е. не зависит от пути перехода системы из начального состояния (1) в конечное состояние (2). Поэтому изменение энтропии в химической реакции равно разности сумм энтропии продуктов реакции и исходных веществ, взятых с учетом стехиометрических коэффициентов, т.е.
 = (∑
= (∑  ) (прод) – (∑
) (прод) – (∑ 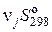 ) (исх).
) (исх).
Из табл. П1 приложения выписываем значения стандартных энтропий веществ, участвующих в реакции
| Вещество | Fe (к) | H2O (г) | Fe3O4 (к) | H2 (г) |
 , Дж/(моль·K) , Дж/(моль·K)
| 27,1 | 188,7 | 146,2 | 130,6 |
Рассчитываем  реакции:
реакции:
 =[
=[  (Fe3O4) + 4
(Fe3O4) + 4  (H2)] – [3
(H2)] – [3  (Fe) + 4
(Fe) + 4  (H2O)] = [146,2 + 4 · 130,6] – – [4 · 188,7 + 3 · 27,1] = – 167,5 Дж/K.
(H2O)] = [146,2 + 4 · 130,6] – – [4 · 188,7 + 3 · 27,1] = – 167,5 Дж/K.
Изменение энтропии в результате реакции  < 0, следовательно, при протекании данной реакции система становится более упорядоченной, т.е. беспорядок в системе уменьшается.
< 0, следовательно, при протекании данной реакции система становится более упорядоченной, т.е. беспорядок в системе уменьшается.
Пример 4. Как влияет изменение температуры на направление реакций?
1) 2KC1О3 (к) = 2KC1 (к) + 3О2 (г) + Q;
2) N2 (г) + 2О2 (г) = 2NО2 (г) – Q;
3) ЗС2Н2 (г) = С6Н6 (ж) + Q;
4) FeO (к) + H2 (г) = Fe (к) + H2O (г) – Q.
Решение. Изменение энергии Гиббса зависит от изменения энтальпии и энтропии заданного процесса, что видно из уравнения Гиббса:
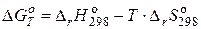 .
.
Знак  определяем по термохимическим реакциям: 1 и 3 – экзотермические (Q > 0), а реакции 2 и 4 – эндотермические (Q < 0), т.е.
определяем по термохимическим реакциям: 1 и 3 – экзотермические (Q > 0), а реакции 2 и 4 – эндотермические (Q < 0), т.е.  < 0;
< 0; 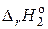 > 0;
> 0;  < 0;
< 0;  > 0. Определяем знак
> 0. Определяем знак  реакций:
реакций:
1)  (1) > 0. Энтропия системы, как мера неупорядоченности, растёт при увеличении количества вещества (моль), тем более что полученные вещества находятся в газообразном состоянии.
(1) > 0. Энтропия системы, как мера неупорядоченности, растёт при увеличении количества вещества (моль), тем более что полученные вещества находятся в газообразном состоянии.
2)  (2) < 0, так как в реакцию вступают три объёма газов, а получается два, т.е. количество вещества (моль газа) уменьшается, и система становится более упорядоченной.
(2) < 0, так как в реакцию вступают три объёма газов, а получается два, т.е. количество вещества (моль газа) уменьшается, и система становится более упорядоченной.
3)  (3) < 0 по той же причине, что и в случае 2.
(3) < 0 по той же причине, что и в случае 2.
4) Вероятно,  (4) > 0, т.к. усложнился состав молекул газа (H2O (г) вместо Н2 (г)), хотя в результате реакции количество вещества (моль) не изменилось.
(4) > 0, т.к. усложнился состав молекул газа (H2O (г) вместо Н2 (г)), хотя в результате реакции количество вещества (моль) не изменилось.
Итак, для реакции 1:
 < 0,
< 0,  (1) > 0,
(1) > 0,  (1) < 0 – реакция будет протекать самопроизвольно при любой температуре.
(1) < 0 – реакция будет протекать самопроизвольно при любой температуре.
Для реакции 2:
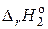 > 0,
> 0,  (2) < 0,
(2) < 0,  (2) > 0 – реакция в указанном направлении не протекает ни при каких температурах.
(2) > 0 – реакция в указанном направлении не протекает ни при каких температурах.
Для реакции 3:
 < 0,
< 0,  (3) < 0,
(3) < 0,  (3) < 0 – реакция может протекать самопроизвольно при достаточно низких температурах. При высоких температурах |Т·DS| > |DН|, DG станет величиной положительной, т.е. реакция самопроизвольно не будет протекать.
(3) < 0 – реакция может протекать самопроизвольно при достаточно низких температурах. При высоких температурах |Т·DS| > |DН|, DG станет величиной положительной, т.е. реакция самопроизвольно не будет протекать.
Для реакции 4:
 > 0,
> 0,  (4) > 0, при низких температурах
(4) > 0, при низких температурах  (4) > 0 – реакция не протекает. При высоких температурах, когда |Т·DS| > |DН|,
(4) > 0 – реакция не протекает. При высоких температурах, когда |Т·DS| > |DН|,  < 0 – реакция станет возможной.
< 0 – реакция станет возможной.
Пример 5. Определите, при какой температуре: 298 K или 1705 K – целесообразнее проводить процесс получения «генераторного газа» (смеси двух газов – восстановителей CO (г) и H2 (г))
C (к) + H2О (г) = CO (г) + H2 (г),
чтобы выход продукта по реакции был максимальным.
Решение. Из табл. П1 приложения выписываем значения  и
и  для исходных веществ и продуктов реакции:
для исходных веществ и продуктов реакции:
| Вещество | С(к) | H2O(г) | СO(г) | H2(г) |
 , кДж/моль , кДж/моль
| – 241,8 | – 110,5 | ||
 , Дж/(моль·K) , Дж/(моль·K)
| 5,7 | 188,7 | 197,5 | 130,5 |
Согласно следствию из закона Гесса рассчитываем  реакции:
реакции:
 =
=
= – 110,5 + 241,8 = 131,3 кДж, т.е.  > 0.
> 0.
Аналогично рассчитываем  :
:
 =
=
= 197,5 + 130,5 – 5,7 – 188,7 = 133,6 Дж/K = 0,134 кДж/K,  > 0.
> 0.
Находим ΔGo реакции при Т = 298 K, используя уравнение Гиббса:
 =
=  – Т·
– Т·  ,
,
где  и
и  – стандартные изменения энтальпии и энтропии реакции.
– стандартные изменения энтальпии и энтропии реакции.
Итак, при Т = 298 K  = 131,3 – 298·(0,134) = 91,37 кДж. Полученное значение
= 131,3 – 298·(0,134) = 91,37 кДж. Полученное значение  > 0, что говорит о невозможности протекания реакции в прямом направлении при температуре 298 K. Поскольку в реакции
> 0, что говорит о невозможности протекания реакции в прямом направлении при температуре 298 K. Поскольку в реакции  > 0 и
> 0 и  > 0, то следует ожидать, что повышение температуры будет способствовать протеканию процесса в прямом направлении.
> 0, то следует ожидать, что повышение температуры будет способствовать протеканию процесса в прямом направлении.
Величины  и
и  можно использовать для расчёта
можно использовать для расчёта  при различных температурах, т.к. в нулевом приближении
при различных температурах, т.к. в нулевом приближении  и
и  практически не меняются с изменением температуры.
практически не меняются с изменением температуры.
Рассчитываем  этой реакции при Т = 1705 K:
этой реакции при Т = 1705 K:
 = 131,5 – 1705· (0,134) = – 97,2 кДж.
= 131,5 – 1705· (0,134) = – 97,2 кДж.
Полученная величина  < 0, значит эта реакция может протекать самопроизвольно при Т = 1705 K.
< 0, значит эта реакция может протекать самопроизвольно при Т = 1705 K.
Пример 6. Какой из оксидов – (Na2O, MgO или Аl2О3) в большей степени обладает основными свойствами? Сделайте вывод на основании расчёта  для следующих реакций:
для следующих реакций:
l) Na2О (к) + H2O (ж) = 2NaOH (к);
2) MgO (к) + H2О (ж) = Mg(OH)2 (к);
3) А12О3 (к) + ЗН2О (ж) = 2А1(ОН)3 (к).
Величины  образования исходных веществ и продуктов реакций предложены в табл. П1 приложения.
образования исходных веществ и продуктов реакций предложены в табл. П1 приложения.
Решение. Выписываем необходимые для расчёта значения  образования веществ.
образования веществ.
| Вещество | Na2O (к) | MgO (к) | Al2O3 (к) | H2О (ж) |
 , кДж/моль , кДж/моль
| – 379,3 | – 569,3 | – 1582,3 | – 237,2 |
| Вещество | NaOН (к) | Mg(OН)2 (к) | Al(OН)3 (к) |
 , кДж/моль , кДж/моль
| – 380,3 | – 569,3 | – 1582,3 |
Поскольку энергия Гиббса является функцией состояния, то изменение энергии Гиббса (  ) для химической реакции не зависит от пути перехода системы из начального состояния в конечное состояние, т.е. не зависит от промежуточных стадий процесса, а обусловливается только природой и физическим состоянием исходных веществ и продуктов реакции. Поэтому
) для химической реакции не зависит от пути перехода системы из начального состояния в конечное состояние, т.е. не зависит от промежуточных стадий процесса, а обусловливается только природой и физическим состоянием исходных веществ и продуктов реакции. Поэтому  реакции равнo разности сумм
реакции равнo разности сумм  образования продуктов реакции и исходных веществ с учётом их стехиометрических коэффициентов.
образования продуктов реакции и исходных веществ с учётом их стехиометрических коэффициентов.
 – стандартная энергия Гиббса вещества равна изменению энергии Гиббса при образовании 1 моль сложного вещества из простых в стандартных условиях. Это определение подразумевает, что
– стандартная энергия Гиббса вещества равна изменению энергии Гиббса при образовании 1 моль сложного вещества из простых в стандартных условиях. Это определение подразумевает, что  для простого вещества равно нулю.
для простого вещества равно нулю.
Рассчитываем  реакции 1:
реакции 1:
 (1) =
(1) = 
= 2 × (– 380,3) – [(– 397,3) + (– 237,2)] = – 144,1 кДж.
Для реакции 2:
 (2) =
(2) = 
= – 833,8 – (– 569,3) – (– 237,2) = – 27,3 кДж.
Для реакции 3:
 (3) =
(3) = 
= 2 × (– 1114,0) – (– 1582,3) –3 × (– 237,2) = 7,9 кДж.
В пересчёте на 1 моль Н2О получаем: для реакции 1  (1) = – 144,1 кДж, соответственно для реакции 2
(1) = – 144,1 кДж, соответственно для реакции 2  (2) = – 27,3 кДж и
(2) = – 27,3 кДж и  (3) = + 2,6 кДж для реакции 3.
(3) = + 2,6 кДж для реакции 3.
Сравнивая величины DGо предложенных реакций, видим, что  (1) – величина наименьшая, оксид Na2O в большей степени обладает основными свойствами и легко взаимодействует с водой,. MgO обладает меньшим химическим сродством к воде, чем Na2О. Al2O3 не взаимодействует с водой, т.к.
(1) – величина наименьшая, оксид Na2O в большей степени обладает основными свойствами и легко взаимодействует с водой,. MgO обладает меньшим химическим сродством к воде, чем Na2О. Al2O3 не взаимодействует с водой, т.к.  (3) > 0. Это отвечает тому факту, что NaOH – сильное основание (щёлочь), Mg(OH)2 – основание средней силы, а Аl (ОН)3 – амфотерный гидроксид.
(3) > 0. Это отвечает тому факту, что NaOH – сильное основание (щёлочь), Mg(OH)2 – основание средней силы, а Аl (ОН)3 – амфотерный гидроксид.
Итак, чем меньше алгебраическая величина  , тем больше возможность протекания соответствующего процесса в прямом направлении, тем выше химическое сродство веществ, участвующих в реакции.
, тем больше возможность протекания соответствующего процесса в прямом направлении, тем выше химическое сродство веществ, участвующих в реакции.
Пример 7. В какой среде ион MnO4– является наиболее активным окислителем, если известны  следующих реакций, протекающих в растворах:
следующих реакций, протекающих в растворах:
1) 2МnO4– + 6Н+ + 5SO32– = 2Мn2+ + 5SO42– + ЗН2О,  = – 1566 кДж;
= – 1566 кДж;
2) 2МnO4– + H2O + 3SO32– = 2МnO2¯ + 3SO42– + 2OH–,  = – 876 кДж;
= – 876 кДж;
3) 2МnO4– + 2OH– + SO32– = 2МnO42– + SO42– + Н2О,  = – 290 кДж.
= – 290 кДж.
Решение. По величине  для всех реакций видно, что ион МnO4– сильный окислитель во всех средах (кислой, нейтральной, щелочной), т.к. для каждой из них
для всех реакций видно, что ион МnO4– сильный окислитель во всех средах (кислой, нейтральной, щелочной), т.к. для каждой из них  < 0. Но наиболее сильные окислительные свойства он проявляет в кислой среде (реакция 1), поскольку в этой реакции
< 0. Но наиболее сильные окислительные свойства он проявляет в кислой среде (реакция 1), поскольку в этой реакции  наименьшая (– 1566 кДж).
наименьшая (– 1566 кДж).
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Для решения задач используйте данные табл. П1 приложения.
21. Какие из нижеприведённых процессов характеризуются убылью энтропии:
1) Н2O (ж) ® Н2O (к);
2) H2 (г) + 2Na (к) ® 2NaH (к);
3) 2НI (г) ® Н2 (г) + I2 (к).
Дайте соответствующее пояснение.
22. Вычислите изменение энтропии и энергии Гиббса системы, в которой протекает реакция Са(ОН)2 (к) ® СаО (к) + Н2О (г). Поясните изменение энтропии и объясните возможность (или невозможность) самопроизвольного протекания реакции.
Ответ:  = 143,4 Дж/K;
= 143,4 Дж/K;  = 65,45 кДж.
= 65,45 кДж.
23. При какой температуре процесс FeO (к) + H2 (г) = Fe (к) + H2O (г) становится самопроизвольным в стандартном состоянии, если пренебречь зависимостью  и
и  от температуры?
от температуры?
Ответ: Т = 936,59 K.
24. Предскажите знак изменения энтропии для следующих процессов:
l) CaCО3 (к) ® CaO (к) + CО2 (г);
2) СО (г) + С12 (г) ® СОС12 (г);
3) С2Н4 (г) + Н2 (г) ® С2Н6 (г).
Дайте соответствующее пояснение.
25. На основании результатов расчёта  реакций:
реакций:
1) NH3 (r) + 3/2Cl2 (г) ® l/2N2 (г) + 3HCl (г),
2) NН3 (г) + 3/4О2 (г) ® 1/2N2 (г) + 3/2Н2О (ж),
сравните окислительные свойства хлора и кислорода по отношению к аммиаку.
Ответ:  = – 269,42 кДж,
= – 269,42 кДж,  = – 339,37 кДж.
= – 339,37 кДж.
26. На основании  ,
,  и
и  реакций сделайте заключение, можно ли получить оксид хлора (I) CI2O и оксид серебра (I) Ag2O из простых веществ при стандартных условиях. Рассчитайте, при каких температурах возможно образование этих оксидов.
реакций сделайте заключение, можно ли получить оксид хлора (I) CI2O и оксид серебра (I) Ag2O из простых веществ при стандартных условиях. Рассчитайте, при каких температурах возможно образование этих оксидов.
Ответ: CI2O:  = 75,73 кДж,
= 75,73 кДж,  = – 59,27 Дж/K,
= – 59,27 Дж/K,  = 93,40 кДж;
= 93,40 кДж;
Ag2O:  = –30,54 кДж,
= –30,54 кДж,  = – 65,87 Дж/K,
= – 65,87 Дж/K,  = –10,90 кДж, T < 190,6 ○C.
= –10,90 кДж, T < 190,6 ○C.
27. Могут ли в стандартных условиях самопроизвольно протекать следующие реакции:
1) Fe2О3 (к) + 3H2 (г) ® 2Fe (к) + 3H2О (г),
2) Fe2О3 (к) + 3C (к) ® 2Fe (к) + 3CO (г),
3) Fe2О3 (к) + 2А1 (к) ® 2Fe (к) + А12О3 (к)?
Вывод сделайте на основании расчёта  реакций.
реакций.
Ответ:  = 54,51 кДж,
= 54,51 кДж,  = 328,89 кДж,
= 328,89 кДж,  = – 841,93 кДж.
= – 841,93 кДж.
28. Рассчитайте  и
и  реакции
реакции
С2Н4 (г) + Н2 (г) ® С2Н6 (г).
Возможно ли протекание этой реакции при стандартных условиях? Определите, при каких температурах возможен этот процесс.
Ответ:  = – 136,97 кДж,
= – 136,97 кДж,  = – 120,48 Дж/K, T < 863,87 оC
= – 120,48 Дж/K, T < 863,87 оC
29. Рассчитайте  и
и  следующей реакции:
следующей реакции:
2Ag (к) + 1/2О2 (г) = Ag2О (к).
Возможно ли протекание этой реакции при стандартных условиях? Изменится ли направление реакции: а) при нагревании; б) при охлаждении? При каких температурах данная реакция может протекать самопроизвольно?
Ответ:  = – 30,54 кДж,
= – 30,54 кДж,  = – 65,87 Дж/ K, T < 463,6 K
= – 65,87 Дж/ K, T < 463,6 K
30. Рассчитайте  и
и  реакции окисления нафталина
реакции окисления нафталина
C10H8 (к) + 12 О2 (г) ® 10 СО2 (г) + 4Н2О (г).
Возможно ли протекание этой реакции при стандартных условиях? Изменится ли направление реакции: а) при нагревании; б) при охлаждении?
Ответ:  = – 4980,41 кДж,
= – 4980,41 кДж,  = 264,1 Дж/ K.
= 264,1 Дж/ K.
31. Определите, может ли протекать реакция образования углекислого газа и водорода при Т = 298 K, и если нет, то определите, при какой температуре реакция Н2О (г) + 1/2 С (к) ® 1/2 СО2 (г) + Н2 (г) возможна. Зависимостью  и
и  от температуры можно пренебречь.
от температуры можно пренебречь.
Ответ:  = 31,425 кДж, Т > 711,59 оC.
= 31,425 кДж, Т > 711,59 оC.
32. Какие из оксидов СuО, РbО, СаО, Сr2О3 можно восстанавливать водородом в стандартных условиях? Ответ подтвердите расчётом  соответствующих реакций.
соответствующих реакций.
Ответ:  = – 94,35;
= – 94,35;  = – 40,41;
= – 40,41;  = 374,85;
= 374,85;  = 373,14 кДж.
= 373,14 кДж.
33. Известно, что устойчивость оксидов металлов обычно с повышением температуры уменьшается. Объясните это явление качественно на основании зависимости  от температуры для процесса 2Me (к) + О2 (г) = 2MeO (к).
от температуры для процесса 2Me (к) + О2 (г) = 2MeO (к).
34. Вычислите  реакции 4Р (к) + 5СО2 (г) = 2Р2О5 (к) + 5С (к).
реакции 4Р (к) + 5СО2 (г) = 2Р2О5 (к) + 5С (к).
Можно ли потушить горящий фосфор углекислым газом?
Ответ:  = – 771,55 кДж.
= – 771,55 кДж.
35. Определите термодинамическую вероятность протекания процессов:
1) 4KC1О3 (к) = 3KCIО4 (к) + KC1 (к);
2) 2KСlО3 (к) = 2KСl (к) + 3О2 (г).
Для какого процесса  зависит от температуры сильнее?
зависит от температуры сильнее?
Ответ:  = – 151,47 кДж,
= – 151,47 кДж,  = – 36,21 Дж/K;
= – 36,21 Дж/K;
 = – 238,26 кДж,
= – 238,26 кДж,  = 494,28 Дж/K.
= 494,28 Дж/K.
36. Вычислите  для реакции 2NH3 (г) + 5/2О2 (г) ® 2NO (г) + 3Н2О (ж)
для реакции 2NH3 (г) + 5/2О2 (г) ® 2NO (г) + 3Н2О (ж)
и определите принципиальную возможность или невозможность осуществления этой реакции в стандартных условиях. При каких температурах возможен этот процесс?
Ответ:  = – 583,09 кДж;
= – 583,09 кДж;  = – 266,79 Дж/K;
= – 266,79 Дж/K;  = – 503,57 кДж;
= – 503,57 кДж;
до 1912,6 оC.
37. Вычислите  для реакции 2C2H2 (г) + 5О2 (г) ® 4CO2 (г) + 2H2O (г)
для реакции 2C2H2 (г) + 5О2 (г) ® 4CO2 (г) + 2H2O (г)
и определите принципиальную возможность или невозможность осуществления этой реакции в стандартных условиях.
Ответ:  = – 2453,12 кДж.
= – 2453,12 кДж.
38. Вычислите  для реакции SО2 (г) + 2H2S (г) ® 3S (к) + 2H2O (ж).
для реакции SО2 (г) + 2H2S (г) ® 3S (к) + 2H2O (ж).
Определите принципиальную возможность или невозможность осуществления этой реакции в стандартных условиях. При каких температурах возможен этот процесс?
Ответ:  = – 233,56 кДж;
= – 233,56 кДж;  = – 423,81 Дж/K;
= – 423,81 Дж/K;  = – 107,25 кДж;
= – 107,25 кДж;
Т < 278 оC.
39. Вычислите  следующей реакции N2О (г) + 1/2O2 (г) ® 2NO (г).
следующей реакции N2О (г) + 1/2O2 (г) ® 2NO (г).
Определите принципиальную возможность или невозможность осуществления этой реакции в стандартных условиях. При каких температурах возможен этот процесс?
Ответ:  = 100,51 кДж;
= 100,51 кДж;  = 98,93 Дж/K;
= 98,93 Дж/K;  = 71,04 кДж; Т > 742,9 оC.
= 71,04 кДж; Т > 742,9 оC.
40. Вычислите  следующей реакции 2НС1 (г) + 1/2О2 (г) ® С12 (г) + Н2О (ж).
следующей реакции 2НС1 (г) + 1/2О2 (г) ® С12 (г) + Н2О (ж).
Определите принципиальную возможность или невозможность осуществления этой реакции в стандартных условиях. При каких температурах возможен этот процесс?
Ответ:  = – 100,21 кДж;
= – 100,21 кДж;  = – 183,17 Дж/K;
= – 183,17 Дж/K;  = – 46,63 кДж;
= – 46,63 кДж;
Т < 279,55 оC.
3. ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
При изучении этой темы и выполнении контрольных заданий рекомендуется обратить основное внимание на следующие вопросы: понятие о скорости химической реакции, гомогенные и гетерогенные реакции, зависимость скорости химической реакции от концентрации – закон действующих масс (ЗДМ) – основной закон химической кинетики для элементарной стадии, константа скорости реакции, зависимость скорости реакции от температуры, правило Вант-Гоффа, химическое равновесие, динамический характер химического равновесия, выражение для константы равновесия, смещение химического равновесия при изменении внешних условий протекания реакций, принцип Ле- Шателье [1, 2, 8].
|
из
5.00
|
Обсуждение в статье: НАПРАВЛЕННОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

