 |
Главная |
Эквивалент, фактор эквивалентности, молярная концентрация эквивалентов
|
из
5.00
|
Пример 2. Вычислите молярную концентрацию эквивалентов ортофосфорной кислоты в 20%-ном растворе H3PO4, плотность которого 1,020 г/см3, учитывая уравнение
H3PO4 + 3KOH = K3PO4 + 3H2O.
Решение. Молярная концентрация эквивалентов вещества х (символ Сэкв(х), единица измерения моль/м3 или моль/л) определяется количеством вещества эквивалентов nэкв (х), находящихся в 1 л раствора.
Молярная концентрация эквивалентов зависит от реакции, так как, одно и то же вещество в различных реакциях может иметь разные значения эквивалентного числа.
1. Рассчитываем фактор эквивалентности H3PO4 в данной реакции.
Реагент КОН обменивает с одной формульной единицей 1 ФЕ (H3PO4) три гидроксильные группы ОН–, каждая их которых эквивалентна иону Н+. Следовательно, эквивалентное число Z (H3PO4) = 3, фактор эквивалентности f (H3PO4) = 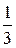 .
.
2. Рассчитываем молярную массу эквивалентов.
Молярная масса эквивалентов H3PO4 равна произведению фактора эквивалентности H3PO4 на молярную массу H3PO4 (98 г/моль):
Мэкв(H3PO4) = f (H3PO4) ·  = 1/3 · 98 = 32,66 г/моль.
= 1/3 · 98 = 32,66 г/моль.
3. Вычислим массу 1 л раствора, исходя из значений плотности:
m = V · ρ = 1000 мл · 1,020 г/см3 = 1020 г.
Содержание H3PO4 в 1 л раствора найдем из пропорции:
в 100 г раствора H3PO4 содержится 20 г H3PO4;
в 1020 г раствора H3PO4 содержится х г H3PO4,
х =  г.
г.
4. Определим количество эквивалентов вещества H3PO4 в 1 л раствора.
Количество вещества эквивалентов показывает количество вещества (в молях), в котором частицами являются эквивалентны (реальные или условные частицы вещества).
Количество вещества эквивалентов H3PO4 в 1 л раствора получим делением числа граммов H3PO4 в 1 л раствора на молярную массу эквивалентов H3PO4:
nэкв(Н3PO4) =  моль,
моль,
т.е. получим 6,25 моль вещества.
Значит Сэкв (H3PO4, f = 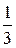 ) = 6,25 моль/л. Этот способ выражения концентрации еще называется нормальностью раствора (н) и записывается 6,25н H3PO4, т.е. 1 л этого раствора содержит 6,25 моль эквивалентов ортофосфорной кислоты.
) = 6,25 моль/л. Этот способ выражения концентрации еще называется нормальностью раствора (н) и записывается 6,25н H3PO4, т.е. 1 л этого раствора содержит 6,25 моль эквивалентов ортофосфорной кислоты.
Пример 3. Учитывая уравнение реакции
KOH + H2SO4 = KHSO4 + H2O,
рассчитайте фактор эквивалентности f (KOH) и f (H2SO4). Определите молярную концентрацию эквивалентов раствора серной кислоты H2SO4, если на нейтрализацию 24,5 мл кислоты потребовалось 23,0 мл раствора гидроксида калия KOH, Сэкв(KOH) = 0,15 моль/л.
Решение. Растворы различной молярной концентрации эквивалентов взаимодействуют в объемах, обратно пропорциональных их молярным концентрациям эквивалентов.
Зная молярную концентрацию эквивалентов одного из двух реагирующих растворов и их объемы, определяем молярную концентрацию эквивалентов второго раствора:
 или Сэкв(А) · Vp(A) = Cэкв(В) · Vp(B),
или Сэкв(А) · Vp(A) = Cэкв(В) · Vp(B),
1. Рассчитаем фактор эквивалентности f (KOH) и f (H2SO4). Реагент KOH обменивает с одной формульной единицей 1 ФЕ H2SO4 одну гидроксильную группу ОН–, которая эквивалентна иону Н+. Следовательно, эквивалентное число Z(H2SO4) = 1, фактор эквивалентности f (H2SO4) = 1.
Эквивалентное число Z(KOH) = 1, f (KOH) = 1.
2. Вычислим молярную концентрацию эквивалентов раствора H2SO4.
 , отсюда
, отсюда
Сэкв(Н2SO4, Н2О, f = 1) =  =
=
= 0,14 моль/л или 0,14н H2SO4.
Пример 4. Определить массу (г) перманганата калия KMnO4, необходимую для приготовления 0,5 л 0,2н раствора, предназначенного для изучения окислительных свойств вещества в кислой среде
(MnO4)– + 8H+ + 5e– = Mn2+ + 4H2O.
Решение.
1. Определим фактор эквивалентности f (KMnO4).
Ионно-электронное уравнение полуреакции показывает, что степень окисления марганца изменяется от +7 до +2. Одна формульная единица (MnO4)–присоединяет пять электронов, поэтому эквивалентное число Z(MnO4–) = 5. Следовательно, и эквивалентное число KMnO4 равно Z(KMnO4) = 5, фактор эквивалентности f (KMnO4) =  . Молярная масса KMnO4 равна
. Молярная масса KMnO4 равна  = 158 г/моль.
= 158 г/моль.
2. Вычислим массу KMnO4 необходимую для приготовления 0,5 л 0,2н раствора.
Молярная концентрация эквивалентов Сэкв(х) равна отношению количества вещества эквивалентов nэкв(х) к объему раствора Vp:
 ,
,
где mx – масса вещества (г);
f (x) – фактор эквивалентности;
Мх – молярная масса вещества, г/моль;
Vp – объем раствора (л).
Отсюда можно рассчитать массу вещества:
 ,
,
 г.
г.
Ответ: Для приготовления 0,5 л 0,2н раствора необходимо взять 3,16 г KMnO4.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
121. К раствору серной кислоты объемом 400 мл, плотность которого равна 1,1 г/мл, а массовая доля H2SO4 15 %, добавили воду массой 60 г. Определите массовую долю серной кислоты в полученном растворе.
Ответ: 13,2%.
122. Рассчитайте молярную концентрацию (моль/л) хлорида марганца (II) MnCl2, если в 200 мл раствора содержится 2,52 г растворенного вещества.
Ответ: 0,1М.
123. Рассчитайте молярную концентрацию эквивалентов (моль/л) хлорида цинка ZnCl2, в 200 мл раствора которого содержится 1,83 г этого вещества. Реакция протекает по уравнению:
ZnCl2 + 4NaOH = Na2[Zn(OH)4] + 2NaCl.
Ответ: 0,3 моль/л.
124.Определите массу (г) перманганата калия KMnO4, необходимую для приготовления 1,5 л 0,3н раствора, предназначенного для изучения окислительных свойств этого вещества в нейтральной среде:
(MnO4)– + 3e– + 2H2O = MnO2 + 4(OH)–.
Ответ: 23,7 г.
125. Вычислите титр 40%-ного раствора серной кислоты H2SO4 плотностью ρ = 1,307 г/см3.
Ответ:  = 0,5228 г/мл.
= 0,5228 г/мл.
126. Реакция протекает по уравнению:
3Ba(OH)2 + 2H3PO4 = Ba3(PO4)2 + 6H2O.
Вычислите фактор эквивалентности f (Ba(OH)2) и f (H3PO4). Определите, какой объем ортофосфорной кислоты с Сэкв (H3PO4) = 0,7 моль/л необходим для нейтрализации 30 мл раствора гидроксида бария Ba(OH)2, титр которого 0,0960 г/мл.
Ответ: 48 мл.
127. Рассчитайте массу глюкозы С6Н12О6 и воды, необходимых для приготовления 200 г 5%-ного раствора.
Ответ: 10 г глюкозы, 190 г воды.
128. Определите массу (г) нитрата никеля Ni(NO3)2, содержащегося в 200 мл 0,125М раствора Ni(NO3)2.
Ответ: 4,6 г.
129. Реакция протекает по уравнению:
Cr(NO3)3 + 3NaOH = Cr(OH)3 + 3NaNO3.
Вычислите молярную концентрацию эквивалентов нитрата хрома Cr(NO3)3, в 3 л которого содержится 52,2 г этого вещества.
Ответ: 0,22н.
130. Определите массу (г) дихромата калия K2Cr2O7, необходимую для приготовления 1 л 2н раствора, предназначенного для изучения окислительных свойств этого вещества в кислой среде:
(Сr2O7)2– + 6e– + 14H+ = 2Cr3+ + 7H2O.
Ответ: 98 г.
131. Вычислите титр раствора гидрооксида калия KOH, полученного при растворении 25 г KOH и 160 г воды, если плотность раствора равна 1,24 г/см3.
Ответ: ТKOH = 0,1675 г/мл.
132. Реакция протекает по уравнению:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O.
Рассчитайте фактор эквивалентности f (Zn(OH)2) и f( HCl).Определите, какой объем раствора соляной кислоты HCl, Сэкв(HCl) = 0,1 моль/л необходим для нейтрализации 8 мл раствора гидроксида цинка Zn(OH)2, титр которого 0,0720 г/мл?
Ответ: 112 мл.
133. Смешали 200 г 2%-ного раствора и 300 г 12%-ного раствора хлорида кальция CaCl2. Определите массовую долю СaCl2 в полученном растворе.
Ответ: 8%.
134. Определите массу (г) сульфита натрия Na2SO3, необходимую для приготовления 0,4 л 0,6н раствора, предназначенного для изучения восстановительных свойств этого вещества в щелочной среде
(SO3)2– + 2OH– – 2e = (SO4)2– + H2O.
Ответ: 15,12 г.
135. Сколько граммов кристаллогидрата хлорида бария (BaCl2·2H2O) надо взять для приготовления раствора объемом 0,5 л, в котором массовая доля BaCl2 составляет 0,1 (10%-ный раствор)? Плотность раствора ρ = 1,090 г/см3.
Ответ: 63,92 г.
136. Вычислите молярную концентрацию эквивалентов соляной кислоты в 80 мл раствора, содержащего 3,6 г НСl, вступившей в реакцию по уравнению:
2HCl + Ca(OH)2 = CaCl2 + 2H2O.
Ответ: 1,2н HCl.
137. Вычислите массовую долю (%) Mn(NO3)2 в 0,57М растворе Mn(NO3)2, если плотность этого раствора равна ρ = 1,060г/см3.
Ответ: 9,6 %.
138. Для проведения реакции Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O использовали раствор карбоната натрия (Na2CO3), полученный при растворении 10,6 г соли в одном литре воды. Вычислите молярную концентрацию эквивалентов карбоната натрия в растворе.
Ответ: 0,2н Na2CO3.
139. Из 800 г 2%-ного раствора соляной кислоты HCl выпарили 300 г воды. Рассчитайте массовую долю (%) HCl в оставшемся после выпаривания растворе.
Ответ: 3,2%.
140. Рассчитайте массу K2CO3(г), необходимую для приготовления 100 мл 10%-ного раствора (ρ = 1,0904 г/см3).
Ответ: 10,9 г.
|
из
5.00
|
Обсуждение в статье: Эквивалент, фактор эквивалентности, молярная концентрация эквивалентов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

