 |
Главная |
Степень окисления (СО) атомов некоторых элементов
|
из
5.00
|
| Атомы элемен-тов в химических соедине- ниях | Простое вещеcтво | Водород | Фтор | Щелочные металлы | Щелочно-земельные металлы | Кислород | ||
| с более ЭО эле-ментом | с металлами (гидри-ды) | с более электро-положи-тельными элементами | со фтором | |||||
| СО | +1 | –1 | –1 | +1 | +2 | –2 | +1, +2 |
Пример 1. Определите, используя таблицу, степень окисления (СО): хрома в K2Cr2O7 и серы в сульфит-ионе SO32 2 –.
Решение. Степень окисления – это условный заряд атома в молекуле химического соединения, который определяется из допущения, что общая электронная пара в молекуле полностью смещена в сторону более электроотрицательного атома. Молекула же в целом электронейтральна. Определяем степень окисления хрома, если степень окисления калия +1, а степень окисления кислорода –2.
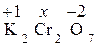 : +2 + 2х – 14 = 0; 2х = 12; х = 6.
: +2 + 2х – 14 = 0; 2х = 12; х = 6.
СО хрома равна +6. Аналогично определяем СО серы в сульфит-ионе, заряд которого равен –2.
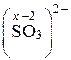 : х – 6 = –2; х = 4.
: х – 6 = –2; х = 4.
Степень окисления (СО) серы в сульфит-ионе равна +4.
Пример 2. Определите, какие из нижеприведенных реакций:
a) Zn + H2CO4 (разб) = ZnSO4 + H2↑;
б) ZnO + CO2 = ZnCO3;
в) MnO2 + Al = Al2O3 + Mn,
являются окислительно-восстановительными. Укажите окислитель и восстановитель, процессы окисления и восстановления. Расставьте коэффициенты, используя метод электронного баланса.
Решение. В окислительно-восстановительных реакциях изменяются степени окисления атомов элементов реагирующих веществ. Находим СО всех атомов в реакции а):
 .
.
Изменились СО атомов элементов цинка и водорода, следовательно, реакция а) окислительно-восстановительная.
Произошли следующие изменения:
30Zn2+ 1s22s22p63s23p63d104s2,
30Zn0 1s22s22p63s23p63d104s0.
Как видно из электронных формул, атом цинка отдал два электрона. СО его повысилась:
Zn0 – 2ē = Zn2+
восстановительная окисленная
форма форма
Атом, молекула или ион, отдающий электроны, называется восстановителем, а процесс отдачи электронов называется окислением.
Восстановитель Zn – окисляется.
Водород-ион принял один электрон Н0, степень окисления его понизилась:
2Н+ + 2ē = Н2 0
окисленная восстановительная
форма форма
Атом, молекула или ион, принимающий электроны, называется окислителем, а процесс отдачи электронов называется восстановлением.
Окислитель – ион (Н+) восстанавливается.
В любой окислительно-восстановительной реакции число электронов, отданных восстановителем, равно числу электронов, принятых окислителем, т.е. устанавливается электронный баланс:
| восстановитель Zn0 – 2ē = Zn2+ окислитель 2H+ + 2ē = Н2 0 | окисляется восстанавливается | |
| Zn0 + 2H+ = Zn2+ + Н2 0. |
В реакции б) СО элементов не меняется:
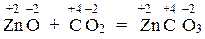 ,
,
следовательно, эта реакция не окислительно-восстановительная.
В реакции в) изменяются степени окисления атомов реагирующих веществ:
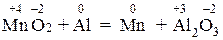 ,
,
следовательно, реакция окислительно-восстановительная. Подберем коэффициенты в уравнения методом электронного баланса:
| восстановитель Al0 – 3ē = Al3+ окислитель Mn4+ + 4ē = Mn0 | окисляется восстанавливается | |
| 4Al0 + 3Mn4+ = 4Al3+ + 3Mn 0 |
Для подбора коэффициентов находим наименьшее общее кратное числу электронов, участвующих в реакции. Это наименьшее кратное (12) делим на число электронов, отданных восстановителем (3) и принятых окислителем (4), получаем соответствующие коэффициенты перед окислителем и восстановителем в данной реакции:
4Al + 3MnO2 = 2Al2O3 + 3Mn.
В сложных реакциях перед веществами, атомы которых не меняют СО, коэффициенты находят подбором.
Пример 3. Определите, исходя из степени окисления азота: а) какие частицы N2 0, NН4 +, NO3 –, NO2 – могут проявлять свойства только восстановителя, только окислителя, окислителя и восстановителя; б) укажите, что представляет собой каждый из процессов:
1) N 2 0 ®NO; 2) NH 4 +® NH3; 3) NO 2– ®NO3 –; 4) NO 3 – ® NH4 +.
Решение.
Определим СО азота в предложенных частицах: N2 0; 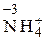 ;
; 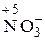 ;
; 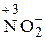 Строение нейтрального атома азота следующее: 7N0 1s22s22p3. а внешнем энергетическом уровне атома пять электронов. В частице NH4 +СО атома азота равна – 3, 7N–31s22s22p6, т.е. на внешнем энергетическом уровне максимальное количество электронов – восемь. Такая частица может только отдавать электроны, т.е. окисляться, следовательно, проявляет только восстановительные свойства. В ионе NO3 –; азот проявляет высшую положительную СО, равную +5, 7N+5 1s22s02p0. Такая частица может принимать электроны, т.е. восстанавливаться, поэтому проявляет только окислительные свойства. В N20и
Строение нейтрального атома азота следующее: 7N0 1s22s22p3. а внешнем энергетическом уровне атома пять электронов. В частице NH4 +СО атома азота равна – 3, 7N–31s22s22p6, т.е. на внешнем энергетическом уровне максимальное количество электронов – восемь. Такая частица может только отдавать электроны, т.е. окисляться, следовательно, проявляет только восстановительные свойства. В ионе NO3 –; азот проявляет высшую положительную СО, равную +5, 7N+5 1s22s02p0. Такая частица может принимать электроны, т.е. восстанавливаться, поэтому проявляет только окислительные свойства. В N20и 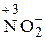 промежуточные степени окисления 0 и +3 соответственно, поэтому эти частицы могут проявлять свойства как окислителя, так и восстановителя.
промежуточные степени окисления 0 и +3 соответственно, поэтому эти частицы могут проявлять свойства как окислителя, так и восстановителя.
Процесс перехода:
1) N2 0®NO, СО азота повысилась от 0 до +2, атом азота отдает 2 электрона, процесс окисления.
2) N 20 ® 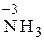 , СО азота понизилась от 0 до –3, процесс восстановления, принимается 3 электрона.
, СО азота понизилась от 0 до –3, процесс восстановления, принимается 3 электрона.
3) 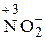 ®
® 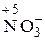 , СО азота повысилась от +3 до +5, процесс окисления, отдается 2 электрона.
, СО азота повысилась от +3 до +5, процесс окисления, отдается 2 электрона.
4)  ®
® 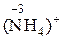 , СО азота понизилась от + 5 до –3, процесс восстановления, принимается 8 электронов.
, СО азота понизилась от + 5 до –3, процесс восстановления, принимается 8 электронов.
Пример 4. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:
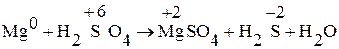 .
.
Подберите коэффициенты электронно-ионным методом.
Решение. Для подбора коэффициентов в реакциях, протекающих в растворах электролитов, удобно использовать метод электронно-ионного баланса.
1. Из уравнения реакции видно, что Mg меняет СО от 0 до +2, т.е. он окисляется и является восстановителем. Сера изменяет СО от +6 до –2, т.е. она восстанавливается и является окислителем.
2. Записываем ионно-молекулярное уравнение реакций:
Mg0 + 2H+ + SO42 2– ® Mg2+ + SO42 2–+ H2O.
H2SO4 и MgSO4 – сильные электролиты, H2O – слабый электролит, H2S – газообразное вещество.
3. Записываем уравнения для процесса окисления:
восстановитель Mg0 – 2ē = Mg2+ окисляется.
4. Уравняем число атомов магния. В левой и правой частях уравнения реакции их по одному.
5. Количество атомов уравнено, поэтому подсчитываем сумму зарядов в левой и правой частях уравнения:
уравнение: Mg0 ® Mg2+
заряды 0 +2
сумма зарядов 0 +2
В левой части 2 избыточных отрицательных заряда, поэтому отнимаем 2 электрона и получаем: Mg0 – 2ē ® Mg2+.
6. Проверяем количество отданных электронов по изменению СО магния:
0 ® +2.
7. Записываем уравнения для процесса восстановления, на основании ионного уравнения: SO42 2– ® H2S.
окисленная восстановленная
форма форма
Атомов серы в правой и левой частях по одному.
Уравниваем атомы кислорода. В левой части их 4, а в правой – 0.
Избыточные 4 атома кислорода в левой части уравнения реакции образовали четыре молекулы Н2О:
SO42 2– ® H2S + 4Н2О.
Наконец, уравниваем атомы водорода. В правой части их 10, в левой их нет. Ионно-молекулярное уравнение показывает, что они содержатся в виде Н+ ионов. Добавляем в левую часть 10 ионов Н+:
SO42 2– + 10Н+ ® H2S + 4Н2О.
В кислой среде всегда «избыток» кислорода связывается ионами среды, каждый атом кислорода связывается двумя ионами Н+, образуя молекулу Н2О.
8. Количество атомов всех элементов уравнено, подсчитываем сумму зарядов в правой и левой частях уравнения:
уравнение: SO42 2– + 10Н+ ® H2S + 4Н2О

 заряды –2 +10 0 0
заряды –2 +10 0 0
сумма зарядов +8 0
В левой части 8 избыточных положительных зарядов, поэтому добавляем сюда 8 электронов. Окончательно получается:
SO42 2– + 10Н+ + 8ē ® H2S + 4Н2О.
9. Проверяем число принятых электронов по изменению СО серы: + 6 ® – 2.
В итоге получаем следующую систему уравнений:
| Mg0 – 2ē ®Mg2+ SO42 2– + 10Н+ + 8ē ®H2S + 4Н2О |
10. Находим коэффициенты для процессов окисления и восстановления, используя общее правило. Число отданных и принятых электронов равно 2 и 8. Наименьше кратное – 8, отсюда коэффициенты: для процесса окисления 4, для процесса восстановления – 1. Проверяем: отдается (2 ´ 4) восемь электронов, принимается также восемь. Складываем электронные уравнения процессов окисления и восстановления, умножив их на соответствующие коэффициенты, и получаем полное ионно-молекулярное уравнение реакции:
2Mg0 + SO42 2–+ 10Н+ ® 4Mg2+ + H2S + 4Н2О.
11. Перенесем полученные коэффициенты в молекулярное уравнение:
4Mg + 5H2SO4 ® 4MgSO4 + H2S + 4Н2О.
Эти же коэффициенты можно получить методом электронного баланса:
| Mg0 – 2ē ® Mg2+ S+6 + 8ē ® S2– |
Mg0 + S+6 ® Mg2+ + S2–,
4Mg + 5H2SO4 ® 4MgSO4 + H2S + 4Н2О.
Пример 5. Расставьте коэффициенты в уравнении реакции, идущей по схеме:
K[Cr(OH)4] + Cl2 + KOH®K2CrO4 + KCl + H2O.
Решение.
1. Находим окислитель и восстановитель в реакции и записываем ионно-молекулярное уравнение. В него должны войти частицы, содержащие окислитель и восстановитель, частицы – продукт окисления и восстановления, а также ионы и молекулы среды, участвующие в реакции:
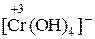
 + Cl2 + OH– ®
+ Cl2 + OH– ® 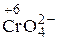 + Cl–+ H2O.
+ Cl–+ H2O.
восстановитель окислитель
2. Записываем уравнения для процесса окисления восстановителя, в котором уравниваем число атомов хрома, кислорода и водорода:
[Cr(OH)4] – ® CrO42 2–.
В правой и левой частях уравнения по одному атому хрома, по четыре атома кислорода. Освободившиеся четыре иона водорода в левой части уравнения связываются четырьмя ионами ОН – щелочной среды, образуя молекулы воды:
4Н ++ 4ОН – ® 4H2O.
Для процесса окисления получаем:
[Cr(OH)4] –+ 4OH – ® CrO42 2–+ 4H2O.
 3. Подсчитываем сумму зарядов в левой и правой частях уравнения и определим число электронов, отданных восстановителем:
3. Подсчитываем сумму зарядов в левой и правой частях уравнения и определим число электронов, отданных восстановителем:
уравнение [Cr(OH)4] –+ 4OH – ® CrO42 2– + 4H2O
сумма зарядов –5 –2
Поскольку в левой части уравнения на три отрицательных заряда больше, вычитаем три электрона:
[Cr(OH)4] –+ 4OH –– 3ē ® CrO42 2–+ 4H2O.
4. Проверяем правильность составления процесса окисления по СО хрома: хром меняет СО от +3 до +6, следовательно, хром отдает три электрона.
1. Записываем уравнение для процесса восстановления:
Cl2 ® 2Cl– .
Хлор меняет СО от 0 до –1, т.е. каждый атом хлора принимает по одному электрону: Cl2 + 2 ē ® 2Cl –.
Получаем систему уравнений:
| [Cr(OH)4] –+ 4OH –– 3ē ® CrO42 2–+ 4H2O Cl2 + 2 ē ® Cl – | процесс окисления процесс восстановления |
Умножив уравнения процессов окисления и восстановления на подобранные коэффициенты и сложив их, получаем ионно-молекулярное уравнение окислительно-восстановительной реакции:

 2[Cr(OH)4]–+ 8OH–– 6ē + 3Cl2 + 6ē ® 2CrO42 2– + 6Cl–+ 8H2O.
2[Cr(OH)4]–+ 8OH–– 6ē + 3Cl2 + 6ē ® 2CrO42 2– + 6Cl–+ 8H2O.
Полученные коэффициенты переносим в молекулярное уравнение:
2K[Cr(OH)4] + 3Cl2 + 8KOH ® 2K2CrO4 + 6KCl + 8H2O.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
181. Реакции протекает по схемам:
Na2SO3 + KMnO4 + H2SO4 ® Na2SO4 + MnSO4 + K2SO4 + H2O,
Zn + HNO3 (разб.) ® Zn(NO3)2 + NH4NO3 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций электронно-ионным методом. Для каждой реакции укажите, какое вещество является окислителем, какое восстановителем, какое вещество окисляется, какое восстанавливается.
182. См. формулировку вопроса задачи № 181.
K2CrO7 + H2S + H2SO4 ® Cr2(SO4)3 + S + K2SO4 + H2O,
Be + HNO3 (конц.) ® Be(NO3)2+ NO2 + H2O.
183. См. формулировку вопроса задачи № 181.
KMnO4 + Na2SO3 + H2O ® MnO2 + Na2SO4 + KOH,
Hg + H2SO4 (конц.) ® HgSO4 + SO2 + H2O.
184. См. формулировку вопроса задачи № 181.
K2S + KMnO4 + H2SO4 ® S + MnSO4 + K2SO4 + H2O,
Zn + H2SO4 (конц.) ® ZnSO4 + H2S + H2O.
185. См. формулировку вопроса задачи № 181.
Mn + HNO3 (разб.) ® Mn(NO3)2 + N2O + H2O,
KI + KMnO4 + H2SO4 ® I2 + K2SO4 + MnSO4 + H2O.
186. См. формулировку вопроса задачи № 181.
Cd + HNO3 (конц.) ® Cd(NO3)2 + NO2 + H2O,
MnSO4 + KClO3 + KOH ® K2MnO4 + KCl + K2SO4 + H2O.
187. См. формулировку вопроса задачи № 181.
Be + H2SO4 ( конц.) ® BeSO4 + H2S + H2O,
KMnO4 + KNO2+ H2SO4 ® MnSO4 + KNO3 + K2SO4 + H2O.
188. См. формулировку вопроса задачи № 181.
MnO2 + KNO3 + KOH ® K2MnO4 + KNO2 + H2O,
Sn + H2SO4 (конц.) ® Sn(SO4)2 + SO2 + H2O.
189. См. формулировку вопроса задачи № 181.
Mn(NO3)2 + KMnO4 + H2O → MnO2 + KNO3 + HNO3,
H2SO3 + HClO3 ® H2SO4 + HCl.
190. См. формулировку вопроса задачи № 181.
KMnO4 + Na3AsO3 + H2SO4 ® MnSO4 + Na3AsO4 + K2SO4 + H2O,
HCl + CrO3 ® Cl2 + CrCl3 + H2O.
191. Определите, какие из перечисленных ниже реакций являются окислительно-восстановительными и расставьте в них коэффициенты электронно-ионным методом:
а) CaO + CO2 ® CaCO3;
б) K2Cr2O7 + H2SO4 ® CrO3 + K2SO4 + H2O;
в) KMnO4 + HBr ® Br2 + KBr + MnBr2 + H2O.
192. Определите, какие из перечисленных ниже реакций являются окислительно-восстановительными и расставьте в них коэффициенты электронно-ионным методом:
а) Ca(HCO3)2 + Ca(OH)2 ® CaCO3 + H2O;
б) Zn + HNO3 ® Zn(NO3)2 + N2O + H2O;
в) K2Cr2O7 + SnSO4 + H2SO4 ® Cr2(SO4)3 + Sn(SO4)2 + K2SO4 + H2O.
193. Составьте электронные уравнения и укажите, какой процесс – окисления или восстановления происходит при следующих превращениях:
а) Mn3+® Mn2+, MnO2 ® Mn2+, MnO42 2– ® MnO4– , Mn2+ ® MnO42 2–.
б) На основании электронных уравнений расставьте коэффициенты электронно-ионным методом в уравнениях реакций, идущих по схемам:
Cd + H2SO4 ( конц.) ® Cd(SO4)2 + SO2 + H2O,
KMnO4 + H3AsO3 + H2SO4 ® MnSO4 + H3AsO4 + K2SO4 + H2O.
194. См. формулировку задачи № 193.
a) MnO42 2– ® MnO4– , SO32 2– ® SO42– , NO3– ® N22 0.
б) Al + HNO3 ( разб.) ® Al(NO3)3 + N2 + H2O,
KMnO4 + Na2SO3 + KOH ® K2MnO4 + Na2SO4 + H2O.
195. См. формулировку задачи № 193.
a) N2 ® NO; N22 ® NH3; NO3– ® NH4+ .
б) MnO2 + HCl (конц.) ® MnCl2 + Cl2 + H2O,
Ca + HNO3 (разб.) → Ca(NO3)2 + NH4NO3 + H2O.
196. См. формулировку задачи № 193.
a) Cr2 O 7 2– ® Cr3+; NO3– ® NO2; CrO2– ® Cr2 O 4 2– .
б) K2Cr2O7 + HCl (конц.) ® Cl2 + CrCl3 + H2O + KCl;
Ni + HNO3 (разб.) ® Ni(NO3)2 + NO2 + H2O.
197. См. формулировку задачи № 193.
a) Cl5+® Cl–; N–3® N5+; Fe3+ ® Fe2+.
б) Sc + HNO3 (разб.) ® Sc(NO3)3 + NH4NO3 +H2O;
FeSO4 + KClO3 + H2SO4 ® Fe2(SO4)3 + KCl + H2O.
198. а) Определите степени окисления железа в следующих частицах:
Fe0; FeOH+; FeO4– ; FeO42–.
б) На основании электронных уравнений, расставьте коэффициенты электронно-ионным методом в уравнении реакции, идущей по схеме:
FeSO4 + K2Cr2O7 + H2SO4 ® Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O.
199. а) Определите степени окисления серы в следующих частицах:
HS–; SO32–; SO42–; S0.
б) На основании электронных уравнений, расставьте коэффициенты электронно-ионным методом в уравнениях реакций, идущих по схемам:
K2Cr2O7 + K2S + H2SO4 ® Cr2(SO4)3 + S + K2SO4 + H2O;
Cu + HNO3 (разб.) ® Cu(NO3)2 + NO + H2O.
200. а) Определите степени окисления титана в следующих частицах:
Ti0; TiOH2+; TiO32–; TiO2+.
б) На основании электронных уравнений, расставьте коэффициенты в уравнениях реакций, идущих по схемам:
Ti + H2SO4 (конц.) ® TiSO4 + S + H2O;
Cd + KMnO4 + H2SO4 ® CdSO4 + K2SO4 + MnSO4 + H2O.
|
из
5.00
|
Обсуждение в статье: Степень окисления (СО) атомов некоторых элементов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

