 |
Главная |
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ И ЭДС
|
из
5.00
|
При изучении этого раздела рекомендуется проработать следующие вопросы: понятие об электродных потенциалах; гальванические элементы (ГЭ); электродвижущая сила гальванического элемента (ЭДС) и ее измерение; стандартный водородный электрод и водородная шкала потенциалов; уравнение Нернста; потенциалы металлических, газовых и окислительно-восстановительных электродов; кинетика электродных процессов; электрохимическая и концентрационная поляризация [1, 10].
Гальванический элемент – электрохимическая система, состоящая из электродов, погруженных в раствор электролитов и соединенных между собой металлическим проводником, образующим внешнюю цепь элемента.
В основе работы гальванического элемента лежат процессы, происходящие на границе металлический электрод – электролит, в результате которых образуется двойной электрический слой. За счет двойного электрического слоя возникает скачок потенциала, называемого электродным. Величина электродного потенциала металла является количественной характеристикой его активности. Для того, чтобы можно было сравнивать активность различных металлов вводится понятие стандартного электродного потенциала jо. Чем более отрицательное значение имеет потенциал металла, тем более сильными восстановительными способностями обладает этот металл. И наоборот, чем более положителен потенциал металлического электрода, тем более сильными окислительными способностями обладают ионы.
Величина потенциала металлического электрода зависит от температуры, активности ионов и рассчитывается по уравнению Нернста
 ,
,
где  – стандартный электродный потенциал, измеренный относительно водородного электрода при стандартных условиях (Т = 298 K;
– стандартный электродный потенциал, измеренный относительно водородного электрода при стандартных условиях (Т = 298 K;  = 1 моль/л, Р = 1 атм) (табл. 9 приложения);
= 1 моль/л, Р = 1 атм) (табл. 9 приложения);
R – универсальная газовая постоянная;
Т – абсолютная температура, K;
n – число электронов, участвующих в процессе;
F – постоянная Фарадея, равная 96 548 Кл/моль;
 – активность ионов металла в растворе, моль/л.
– активность ионов металла в растворе, моль/л.
После подстановки значений постоянных и перевода натурального логарифма в десятичный формула Нернста приобретает вид:
 .
.
Потенциалы водородного и кислородного электродов, являющиеся газовыми электродами, зависят от рН раствора и парциального давления. Потенциалы этих электродов приведены в табл. 10.
Пример 1. Вычислите электродный потенциал водородного электрода в нейтральной среде при  = 1 атм.
= 1 атм.
Решение. Электродный потенциал водородного электрода определяется по уравнению Нернста, исходя из схемы электродного процесса:
 + 2
+ 2  « Н2
« Н2
окисленная восстановленная
форма форма
 .
.
Активность ионов водорода в нейтральной среде а  = 10–7 и
= 10–7 и 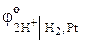 = 0,
= 0,
тогда  = – 0,418 В.
= – 0,418 В.
Полученное значение  сравните с табличным (табл. 10 приложения).
сравните с табличным (табл. 10 приложения).
Пример 2. Серебряный электрод опущен в раствор нитрата серебра AgNO3 с активностью ионов  = 1·10–2 моль/л. Вычислите электродный потенциал.
= 1·10–2 моль/л. Вычислите электродный потенциал.
Решение. Электродный процесс:
 +
+  «
« 
окисленная восстановленная
форма форма
Электродный потенциал серебра рассчитывается по уравнению Нернста:
 = 0,8 + 0,059× lg10–2 = 0,682 B.
= 0,8 + 0,059× lg10–2 = 0,682 B.
Пример 3. Составьте схему гальванического элемента, состоящего из железного и медного электродов, опущенных в растворы собственных солей. Напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС этого ГЭ, если активности ионов в соответствующих растворах следующие:  = 1 · 10–2 моль/л, а
= 1 · 10–2 моль/л, а  = 1,0 моль/л.
= 1,0 моль/л.
Решение. Ионно-электронные уравнения электродных процессов:
А: Fe – 2  ® Fe2+
® Fe2+
K: Cu2+ + 2  ® Cu
® Cu
Железный электрод является анодом, так как его стандартный электродный потенциал (  = – 0,44 В) меньше, чем стандартный потенциал медного электрода (
= – 0,44 В) меньше, чем стандартный потенциал медного электрода (  = + 0,34 В) (табл. 9 приложения).
= + 0,34 В) (табл. 9 приложения).
Схема данного в условии гальванического элемента имеет вид:
(–) Fe | Fe2+ || Cu2+ | Сu (+)
Определяем ЭДС элемента:
ЭДС 
Электродный потенциал анода определяем по уравнению Нернста, а потенциал катода является стандартной величиной:
 В.
В.
ЭДС = 0,34 – (– 0,499) = 0,839 В.
Пример 4. Схема гальванического элемента имеет вид:
(–) Zn |ZnCl2 || ZnCl2 |Zn (+). Рассчитайте ЭДС этого элемента, если в одном полуэлементе активность ионов цинка 0,001 моль/л, а в другом – 0,01 моль/л. Напишите уравнения анодного и катодного процессов.
Решение. В условии задачи дан концентрационный гальванический элемент. В таком элементе катодом будет цинк, опущенный в раствор соли с более высокой активностью ионов Zn2+ = 0,01 моль/л.
Уравнение электродных процессов:
А: Zn – 2  ® Zn2+
® Zn2+
K: Zn2+ + 2  ® Zn
® Zn
Определяем ЭДС элемента:
ЭДС  .
.
Электродные потенциалы находим по уравнению Нернста:
 ,
,
 ;
;
 В;
В;
ЭДС  = – 0,819 – (– 0,848) = 0,029 В.
= – 0,819 – (– 0,848) = 0,029 В.
Пример 5. Для гальванического элемента:
(–) Mn | Mn2+ || 2H+ | H2, Ni (+)
напишите уравнения электродных процессов и рассчитайте реальную ЭДС с учетом перенапряжения выделения водорода, если активность ионов марганца 1 · 10–2 моль/л, а ионов водорода 1,0 моль/л (при  = 1 атм).
= 1 атм).
Решение. Уравнения электродных процессов:
А: Mn – 2  ® Mn2+
® Mn2+
K: 2H+ + 2  ® H2 (в кислой среде на катоде идет процесс водородной деполяризации)
® H2 (в кислой среде на катоде идет процесс водородной деполяризации)
При работе гальванического элемента ЭДС и ток уменьшаются. Это связано с изменениями электродных потенциалов анода и катода. Изменение электродных потенциалов, приводящее к уменьшению ЭДС и силы тока, называется поляризацией.
Различают три вида поляризации: газовую, концентрационную и электрохимическую. Разность между равновесным потенциалом электрода и его потенциалом в том же растворе при прохождении электрического тока, называется перенапряжением (табл. 11 приложения).
В условиях данной задачи перенапряжение выделения водорода на катоде  = 0,30 В (табл. 11 приложения), а электродный потенциал водородного электрода в кислой среде при давлении водорода 1 атм принят равным нулю:
= 0,30 В (табл. 11 приложения), а электродный потенциал водородного электрода в кислой среде при давлении водорода 1 атм принят равным нулю:  = 0. Потенциал катода с учетом перенапряжения
= 0. Потенциал катода с учетом перенапряжения  определяется:
определяется:
 В.
В.
Электродный потенциал анода определяем по формуле  . Так как перенапряжение металла на металле условно принято равным нулю, то
. Так как перенапряжение металла на металле условно принято равным нулю, то  .
.
 ,
,
 В;
В;
ЭДС = – 0,30 – (–1,239) = 0,939 В.
Пример 6. Вычислите величину потенциала окислительно-восстановитель-ного электрода Pt | Sn4+, Sn2+. Реакция восстановления Sn4+ + 2  ® Sn2+ протекает в растворе с активностями ионов
® Sn2+ протекает в растворе с активностями ионов  = 0,1моль/л,
= 0,1моль/л,  = 0,001 моль/л.
= 0,001 моль/л.  .
.
Решение. Потенциал окислительно-восстановительного электрода определяется по уравнению:
 .
.
Тогда  .
.
Пример 7. Железный электрод в растворе своей соли имеет электродный потенциал  . Вычислите активность ионов в растворе, моль/л.
. Вычислите активность ионов в растворе, моль/л.
Решение. Определяем активность ионов железа, используя уравнение Нернста:

так как  = – 0,44 В (табл. 9 приложения), а n = 2, то
= – 0,44 В (табл. 9 приложения), а n = 2, то
 ;
;
 ;
;
 ,
,  моль/л.
моль/л.
Пример 8. Вычислите стандартную ЭДС гальванического элемента, в котором установилось равновесие:
Zn + 2Ag+ « Zn2+ + 2Ag ,
если  = – 146,5 кДж/моль, а
= – 146,5 кДж/моль, а  = 77,2 кДж/моль.
= 77,2 кДж/моль.
Решение. Стандартная ЭДС гальванического элемента определяется по уравнению:
–  ,
,
где nF – количество электричества, которое теоретически можно получить при электрохимическом превращении одного моля вещества;
F – постоянная Фарадея (F = 96,548 кДж/В · моль), или F » 96 500 Кл/моль,
n – количество электронов, участвующих в процессе, для нашего ГЭ n = 2;
 – стандартная энергия Гиббса данной реакции равна:
– стандартная энергия Гиббса данной реакции равна:
 =
= 
Так как стандартные энергии Гиббса образования простых веществ цинка и серебра равны нулю, то подставляя числовые значения величин, находим:
 = – 146,5 – 2 · 77,2 = – 300,9 кДж.
= – 146,5 – 2 · 77,2 = – 300,9 кДж.

КОНТРОЛЬНЫЕ ЗАДАНИЯ
201. Составьте схему, напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС цинко-магниевого гальванического элемента, в котором активность ионов цинка  = 1·10–1 моль/л, а ионов магния
= 1·10–1 моль/л, а ионов магния  = 1,0 моль/л.
= 1,0 моль/л.
Ответ: 1,571 В.
202. Для гальванического элемента (–) Cr | Cr3+ || 2H+ | H2, Fe (+)
напишите уравнения электродных процессов и рассчитайте реальную ЭДС с учетом перенапряжения выделения водорода, если активность ионов хрома  = 1·10–2 моль/л, а ионов водорода
= 1·10–2 моль/л, а ионов водорода  = 1,0 моль/л (при
= 1,0 моль/л (при  = 1 атм).
= 1 атм).
Ответ: 0,419 В.
203. Алюминиевая и медная пластины соединены внешним проводником и опущены в раствор серной кислоты. Составьте схему гальванического элемента и напишите ионно-электронные уравнения электродных процессов, протекающих на аноде и на катоде.
204. Вычислите электродный потенциал водородного электрода в кислой среде при при  = 2 атм и [ H+ ] = 1 моль/л.
= 2 атм и [ H+ ] = 1 моль/л.
Ответ: – 9× 10–3 В.
205. Составьте схему, напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС железно-ртутного гальванического элемента, в котором активность ионов железа  = 1·10–3 моль/л, а ионов ртути
= 1·10–3 моль/л, а ионов ртути  = 1·10–2 моль/л.
= 1·10–2 моль/л.
Ответ: 1,319 В.
206. Составьте схему гальванического элемента, в основе которого лежит химическая реакция, протекающая по уравнению:
Mg + 2AgNO3 ® Mg(NO3)2 + 2Ag.
Напишите ионно-электронное уравнение электродных процессов и вычислите ЭДС этого элемента, если активность ионов магния  = 0,01 моль/л, а ионов серебра
= 0,01 моль/л, а ионов серебра  = 0,001 моль/л.
= 0,001 моль/л.
Ответ: 3,043 В.
207. Составьте схему гальванического элемента, в основе которого лежит химическая реакция, протекающая по уравнению:
Zn + Pb(NO3)2 ® Zn(NO3)2 + Pb.
Напишите ионно-электронное уравнение электродных процессов и вычислите ЭДС этого элемента, если активность ионов цинка  = 0,001 моль/л, а ионов свинца
= 0,001 моль/л, а ионов свинца  = 0,01 моль/л.
= 0,01 моль/л.
Ответ: 0,659 В.
208. Вычислите величину потенциала окислительно-восстановительного электрода Pt | Fe3+, Fe2+ если  = + 0,77 В, а активности ионов железа в растворе соответственно равны
= + 0,77 В, а активности ионов железа в растворе соответственно равны  = 0,001 моль/л и
= 0,001 моль/л и  = 0,1 моль/л.
= 0,1 моль/л.
Ответ: 0,652 В.
209. Алюминиевый электрод в растворе соли имеет электродный потенциал  . Вычислите активность ионов Al3+, моль/л.
. Вычислите активность ионов Al3+, моль/л.
Ответ: 0,095 моль/л.
210. Какой гальванический элемент называется концентрационным? Составьте схему, напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из двух медных электродов, опущенных в растворы сульфата меди CuSO4 c активностью ионов меди в первом растворе  = 0,01 моль/л и с
= 0,01 моль/л и с  = 0,001 моль/л во втором.
= 0,001 моль/л во втором.
Ответ: 0,029 В.
211. Составьте схемы двух гальванических элементов, в одном из которых цинк был бы катодом, а в другом – анодом. Напишите для каждого из этих элементов ионно-электронные уравнения реакций, протекающих на катоде и аноде.
212. При какой активности ионов Mn2+ (моль/л) потенциал марганцевого электрода будет на 0,018 В меньше его стандартного электродного потенциала?
Ответ: 0,25 моль/л.
213. Потенциал медного электрода в растворе хлорида меди CuCl2 составил 97% от величины его стандартного электродного потенциала. Чему равна активность ионов  , ( моль/л)?
, ( моль/л)?
Ответ: 0,46 моль/л.
214. Для гальванического элемента
(–) Mg | Mg2+ || 2H+| H2, Cu (+)
напишите уравнения электродных процессов и рассчитайте реальную ЭДС с учетом перенапряжения выделения водорода, если активность ионов магния  = 1·10–3 моль/л, а ионов водорода
= 1·10–3 моль/л, а ионов водорода  = 1,0 моль/л (при
= 1,0 моль/л (при  = 1 атм).
= 1 атм).
Ответ: 1,968 В.
215. Вычислите ЭДС гальванического элемента, в котором при 298 K установилось равновесие: Mg + Cd2+ « Mg2+ + Cd, если активность ионов магния  = 0,01 моль/л, а ионов кадмия
= 0,01 моль/л, а ионов кадмия  = 0,1 моль/л. Напишите уравнения электродных процессов.
= 0,1 моль/л. Напишите уравнения электродных процессов.
Ответ: 1,99 В.
216. Вычислите стандартную ЭДС гальванического элемента, в котором установилось равновесие: Fe + Cu2+ « Fe2+ + Cu, если известно, что  = + 66,2 кДж/моль, а
= + 66,2 кДж/моль, а  = – 84,8 кДж/моль.
= – 84,8 кДж/моль.
Ответ: 0,78 В.
217. Составьте схему, напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС железо-медного гальванического элемента, в котором активность ионов железа  = 1·10–2 моль/л, а активность ионов меди
= 1·10–2 моль/л, а активность ионов меди  = 1 моль/л.
= 1 моль/л.
Ответ: 0,839 В
218. Вычислите ЭДС гальванического элемента, в котором при 298 K установилось равновесие: Cd + Cu2+ « Cd2+ + Cu, если активность ионов магния  = 10–3 моль/л, а ионов кадмия
= 10–3 моль/л, а ионов кадмия  = 10–2 моль/л. Напишите уравнения электродных процессов.
= 10–2 моль/л. Напишите уравнения электродных процессов.
Ответ: 0,709 В.
219. Вычислите ЭДС гальванического элемента, в котором при 298 K установилось равновесие: 2Na + H2O(г) + 1/2O2 « 2NaOH (к) ,
если  = – 228,76 кДж/моль, а
= – 228,76 кДж/моль, а  = – 380,46 кДж/моль.
= – 380,46 кДж/моль.
Ответ: 2,76 В.
220. Вычислите величину потенциала окислительно-восстановительного электрода Pt | Co3+, Co2+ с активностями ионов кобальта  = 1 моль/л и
= 1 моль/л и  = 0,001 моль/л, если
= 0,001 моль/л, если  .
.
Ответ: 1,977 В.
|
из
5.00
|
Обсуждение в статье: ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ И ЭДС |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

