 |
Главная |
Аналитические реакции катионов кальция Са (II)
|
из
5.00
|
а) Реакция с оксалатом аммония (фармакопейная).Катионы Са2+ образуют с оксалатом аммония (NH4)2С2O4 белый кристаллический осадок оксалата кальция СаС2O4·Н2О, практически нерастворимого в воде и уксусной кислоте, но легко растворимого в минеральных кислотах:
Ca2+ + C2O42- + H2O → CaC2O4 ∙ H2O↓
CaC2O4 ∙ H2O↓ + H+ → Ca2+ + HC2O4- + H2O
Выполнение реакции.В пробирку вносят 3 капли раствора CaCI2, прибавляют каплю раствора уксусной кислоты и 3 капли раствора оксалата аммония. Выпадает белый кристаллический осадок оксалата кальция.
б) Реакция с серной кислотой или растворимыми сульфатами.В пробирку вносят 5 капель раствора хлорида кальция, прибавляют 2-3 капли раствора серной кислоты. Выпадает белый осадок сульфата кальция.
Ca2+ + SO42- + 2H2O → CaSO4 ∙ 2H2O↓
Выполнение реакции. Каплю раствора хлорида кальция CaCI2 наносят на предметное стекло, прибавляют каплю раствора серной кислоты и слегка упаривают смесь. Под микроскопом наблюдают образовавшиеся игольчатые кристаллы гипса в виде красивых сросшихся пучков или звездочек.
в) Реакция с гидроксидом натрия.В пробирку вносят 4-5 капель раствора хлорида кальция, прибавляют 2-3 капли раствора щелочи. Выпадает белый осадок гидроксида кальция:
Ca2+ + 2OH- → Ca(OH)2↓
Осадок выпадает только из концентрированной щелочи, заметно растворяется в воде.
г) Реакция с карбонатом натрия.В пробирку вносят 3-5 капель раствора хлорида кальция, прибавляют 3 капли раствора Na2CO3. Выпадает аморфный осадок белого цвета:
Ca2+ + CO32- → CaCO3↓
Осадок растворяется в минеральной и уксусной кислоте.
д) Реакция с гексацианоферратом (II) калия.В пробирку вносят 3-5 капель раствора хлорида кальция, 2-3 капли раствора NH4Cl. Нагревают раствор до кипения и прибавляют 5-6 капель насыщенного раствора гексацианоферрата (II) калия. Выпадает белый кристаллический осадок при рН>7:
Ca2+ + K[Fe(CN)6]3- + NH4+ → Ca(NH4) K[Fe(CN)6]↓
Осадок нерастворим в уксусной кислоте. Это позволяет отличить его от SrСO3, который может образоваться в присутствии карбонат-ионов в щелочных растворах. Реакции мешают ионы бария и магния.
Выполнение реакции. В пробирку вносят 3-4 капли насыщенного водного раствора CaCI2, 2-3 капли раствора аммиака. Нагревают раствор до кипения и прибавляют 5-6 капель свежеприготовленного насыщенного раствора гексацианоферрата (II) калия. Выпадает белый кристаллический осадок.
е) Реакция с фторидами натрия и аммония.В пробирку вносят 3-5 капель раствора хлорида кальция, прибавляют столько же раствора NaF или NH4F. Выпадает белый осадок:
Ca2+ + 2F- → CaF2↓
ж) Реакция окрашивания пламени.Каплю раствора кальция внести на кончике платиновой проволоки в бесцветное пламя горелки и наблюдать изменение окраски пламени. Соли кальция окрашивают бесцветное пламя горелки в кирпично-красный цвет.
Выполнение реакции. На кончике платиновой или нихромовой проволоки, смоченной раствором HCI, вносят в пламя газовой горелки несколько кристалликов соли кальция или каплю раствора хлорида кальция. Пламя окрашивается в кирпично-красный цвет.
Аналитические реакции катионов стронция Sr (II).
а) Реакция с серной кислотой или растворимыми сульфатами.В пробирку вносят 1-2 капли раствора хлорида стронция, прибавляют 2-3 капли серной кислоты или сульфата натрия. Выпадает белый кристаллический осадок сульфата стронция:
Sr2+ + SO42- → SrSO4↓
Нагревание раствора на водяной бане ускоряет образование осадка сульфата стронция SrSO4.
Выполнение реакции. 1) Реакция с «гипсовой водой». В пробирку вносят 4 капли раствора хлорида стронция, прибавляют 5-6 капель «гипсовой воды», нагревают на водяной бане и оставляют на ~10-15 мин. Постепенно выделяется белый осадок сульфата стронция.
2) Реакция с серной кислотой. В пробирку вносят 1-2 капли раствора хлорида стронция, прибавляют 2-3 капли раствора серной кислоты. Выпадает белый кристаллический осадок сульфата стронция.
б) Реакция с гидроксидом натрия NaOH.В пробирку вносят 2-3 капли раствора хлорида стронция, прибавляют 2-3 капли H2SO4. Выпадает белый осадок Sr(OH)2.
в) Реакция с карбонатом натрия Na2CO3.В пробирку вносят 3-5 капель раствора хлорида стронция, прибавляют столько же капель раствора карбоната натрия и осторожно нагревают пробирку с раствором. Выпадает белый осадок карбоната стронция, растворимый в уксусной и минеральных кислотах:
Sr2+ + CO32- → SrCO3↓
Выполнение реакции. В пробирку вносят 3-5 капель раствора хлорида стронция, прибавляют столько же капель раствора карбоната аммония (NH4)2CO3 и осторожно нагревают пробирку с раствором. Выпадает белый осадок карбоната стронция.
г) Реакция с фторидами натрия и аммония.В пробирку вносят раствор хлорида стронция, прибавляют раствор фторида натрия или фторида аммония. Выпадает белый осадок фторида стронция 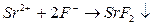 , который разлагается при нагревании с концентрированной серной кислотой.
, который разлагается при нагревании с концентрированной серной кислотой.
д) Реакция с оксалатом аммония (фармакопейная).Катионы Sr2+ образуют с оксалатом аммония (NH4)2С2O4 белый кристаллический осадок оксалата стронция СаС2O4, практически нерастворимого в воде и уксусной кислоте, но легко растворимого в минеральных кислотах:
Sr2+ + C2O42- → SrC2O4↓
SrC2O4 + H+ → Sr2+ + HC2O4-
Аналитические реакции катионов бария Ba (II).
а) Реакция с серной кислотой или растворимыми сульфатами.В пробирку вносят 2-3 капли BaCl2, прибавляют по каплям раствор H2SO4 или Na2SO4. Выпадает белый мелкокристаллический осадок сульфата бария, нерастворимый в разбавленных сильных кислотах. Растворимость его сильно повышается в концентрированной H2SO4 вследствие образования HSO4- .
Ba2+ + SO42- → BaSO4↓
Выполнение реакции. В пробирку вносят 2-3 капли раствора BaCl2 , прибавляют по каплям раствор H2SO4. Выпадает белый мелкокристаллический осадок сульфата бария.
б) Реакция с гидроксидом натрия.В пробирку внести 3-5 капель раствора BaCl2, прибавляют раствор NaOH. Выпадает белый осадок Ba(OH)2 из концентрированных растворов , растворимый в минеральных кислотах и уксусной кислоте:
Ba2+ + 2OH- → Ba (OH)2↓
Ba (OH)2↓ + 2H+ → Ba2+ + H2O
в) Реакция с карбонатом натрия Na2CO3.В пробирку внести 3-5 капель раствора BaCl2, прибавляют раствор Na2CO3. Выпадает белый осадок BaCO3. Осадок растворяется в минеральных кислотах и в уксусной кислоте:
Ba2+ + CO32- → BaCO3↓
BaCO3↓ + 2H+ → Ba2+ + H2O + CO2↑
г) Реакция с хроматом калия K2CrO4.Хромат калия образует желтый осадок хромата бария в нейтральном или уксуснокислом растворе ионов Ва2+.
Выполнение реакции. В пробирку вносят 3-5 капель раствора хлорида бария, прибавляют раствор хромата калия. Выпадает желтый осадок BaCrO4, который растворяется в минеральных кислотах и не растворяется в уксусной кислоте.
Ba2+ + CrO42- → BaCrO4↓
д) Реакция с гексацианоферратом (II) калия K4[Fe(CN)6].В пробирку вносят 3-5 капель раствора хлорида бария, прибавляют 3-5 капель раствора K4[Fe(CN)6], выпадает белый осадок K2Ba[Fe(CN)6]. Осадок растворим в минеральных кислотах:
Ba2+ + K2[Fe(CN)6]2- → BaK2[Fe(CN)6]↓
е) Реакция с фторидами натрия NaF или аммония NH4F.В пробирку вносят 3-5 капель раствора хлорида бария, прибавляют раствор фторида натрия или фторида аммония. Выпадает белый осадок фторида бария, который разлагается при нагревании с концентрированной серной кислотой:
Ba2+ + 2F- → BaF2↓
ж) Реакция с двузамещенным фосфатом натрия Na2HPO4.В пробирку вносят 4-5 капель раствора двузамещенного фосфата натрия и 4-5 капель раствора хлорида бария. Выпадает белый хлопьевидный осадок ВаНРО4:
Ba2+ + HPO42- → BaHPO4↓
Осадок растворим в разбавленных кислотах.
V. Литература.
1. Ю. Я. Харитонов. Аналитическая химия ч. 1. Высшая школа, М., 2001, гл. З, с.54-78.
2. В.П. Васильев. Аналитическая химия. Книга 1. Титриметрические и гравиметрический методы анализа. Высшее образование. М., 2004 г. С. 49-67.
3. Ю. Я. Золотов. Основы аналитической химии. Практическое руководство. Высшая школа, М., 2001. с.25-35.
4. Лекции.
З А Н Я Т И Е № 3.
I. Тема: Аналитические реакции катионов четвертой и пятой групп.
II. Цель: 1. Научиться производить расчеты растворимости, произведения растворимости, молярной концентрации ионов малорастворимого сильного электролита.
2. Сформировать системный подход к рассмотрению гетерогенного равновесия в аналитических реакциях и определять изменение растворимости при добавлении электролита с одноименным ионом и индифферентного электролита, последовательность осаждения из растворов ионов.
3. Научиться определять в пробах катионы IV и V групп.
III. Исходный уровень:
1. Понятие о малорастворимых электролитах.
2. Понятие о гетерогенных системах.
3. Знания условий образования осадков.
IV. Содержание занятия.
1. Контроль выполнения домашнего задания.
2. Практическая часть.
Учебно-целевые вопросы.
2.1. Гетерогенные равновесия в аналитической химии.
2.2. Способы выражения растворимости малорастворимых электролитов.
2.3. Произведение растворимости малорастворимого сильного электролита.
2.4. Условия образования осадков малорастворимых сильных электролитов.
2.5. Дробное осаждение и дробное растворение осадков. Перевод одних малорастворимых электролитов в другие.
2.6. Влияние посторонних электролитов на растворимость малорастворимых сильных электролитов (влияние добавок электролита с одноименным ионом, влияние добавок постороннего индифферентного электролита).
2.7. Влияние различных факторов на полноту осаждения осадков и их растворение.
2.8. Аналитические реакции катионов IV и V групп по кислотно-основной классификации.
Задачи.
2.9. Рассчитайте произведение растворимости хлорида серебра АgСl, если молярная концентрация его насыщенного раствора равна S = 1,33·10-5 моль/дм³.
2.10. Рассчитайте молярную концентрацию катионов свинца [Рb2+] и иодид-ионов [I-] в насыщенном водном растворе иодида свинца PbI2, если его произведение растворимости ПР (РbI2) = 1,1·10-9.
2.11. Как изменится молярная растворимость иодида серебра, если к его насыщенному раствору прибавить иодид калия до концентрации C (KJ) = 1,0·10-4 моль/дм³? Произведение растворимости иодида серебра ПР (AgJ)= 8,3 .10-17.
2.12. Как изменится растворимость оксалата кальция при добавлении в его насыщенный водный раствор хлорида калия КС1 до концентрации С(КС1) = 0,10 моль/дм³? Произведение растворимости оксалата кальция равно ПР (СаС2О4) = 2,3·10-9.
2.13. В водном растворе присутствуют сульфат-ион SO4-2 и оксалат ион С2О42- в одинаковых концентрациях. К этому раствору медленно приливают водный раствор хлорида кальция СаСl2. В какой последовательности будут осаждаться из раствора сульфат – ион и оксалат - ион? Произведения растворимости этих солей равны ПР(СаС 2О4) = 2,3 ·10 -9 и ПР (Са SO4) = 2,5·10 -5.
2.14. В систему состоящую из осадка хромата бария ВаСrО4 и его насыщенного водного раствора, вводят карбонат натрия Nа2СО3. При каком соотношении концентраций карбонат-ионов и хромат-ионов [СО32-] и [СrО42-] осадок превращается в осадок карбоната бария ВаСО3 по реакции:
BaCrO4 (т) + CO32- → BaCO3↓ + CrO42-
Произведения растворимости равны: ПР (ВаСrО4) = 1,2·10 -10;
ПР (ВаСО3) = 4,0·10 -10.
Лабораторные работы.
Аналитические реакции катионов четвертой и пятой групп по кислотно-основной классификации: Zn (II) , Al (III) , Sn (II, IV), As (III, V),Cr (III),
Sb (III, V), Bi (III), Mn (II), Fe (II, III), Мg(II).
Обнаружение катионов четвертой группы.
|
из
5.00
|
Обсуждение в статье: Аналитические реакции катионов кальция Са (II) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

