 |
Главная |
Полная энергия взаимодействия атомов и молекул
|
из
5.00
|
Полная энергия взаимодействия атомов и молекул будет определяться действием сил отталкивания на малых и сил притяжения на больших расстояниях между частицами:
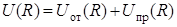 . .
| (3.26) |
При этом силы притяжения могут иметь химическую природу (в случае образования химической связи) или являются силами Ван-дер-Ваальса (в случае физического взаимодействия частиц). Однако и в том, и в другом случае полная энергия взаимодействия частиц на определенном расстоянии R = R0 между частицами (рис.3.3) достигает своего наименьшего значения –U0, которое соответствует состоянию устойчивого равновесия частиц.
В состоянии устойчивого равновесия действие сил отталкивания компенсируется действием сил притяжения, поэтому частицы, предоставленные самим себе, должны выстраиваться в определенном порядке на расстоянии R0 друг от друга, образуя твердое тело с упорядоченной структурой – кристалл.
|
Рис. 3.3. График зависимости полной энергии 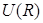 взаимодействия атомов или молекул от расстояния R между ними. В области малых расстояний между частицами полная энергия определяется главным образом их взаимным отталкиванием. В области больших – притяжением частиц. Глубина U0 потенциальной ямы взаимодействия атомов или молекул от расстояния R между ними. В области малых расстояний между частицами полная энергия определяется главным образом их взаимным отталкиванием. В области больших – притяжением частиц. Глубина U0 потенциальной ямы 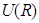 зависит от природы сил притяжения, которые действуют между частицами. зависит от природы сил притяжения, которые действуют между частицами.
|
Частицы кристалла не могут свободно покидать свои положения равновесия, так как при удалении от этих положений энергия частиц увеличивается, и появляются силы, стремящиеся вернуть их назад. Единственной доступной формой движения для таких частиц являются беспорядочные тепловые колебания около равновесных положений.
Такая структура будет сохраняться до тех пор, пока энергия связи U0 остается выше энергии kT теплового движения частиц:
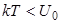 . .
| (3.27) |
При энергиях
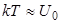
| (3.28) |
частицы получают возможность покидать свои положения равновесия, и кристалл превращается в жидкость, то есть плавится.
Наконец, если энергия теплового движения частиц kT становится заметно больше энергии связи U0,
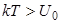 , ,
| (3.29) |
жидкость превращается в пар.
Таким образом, энергия связиU0 определяет температуру плавления (или кристаллизации) вещества, а также его температуру парообразования (или конденсации).
Величина энергии связи зависит от природы сил притяжения, которые действуют между частицами вещества. Энергия химической связи по порядку величины равна 1 – 10 эВ (200 – 2000 кДж∙моль–1). В случае действия сил Ван-дер-Ваальса энергия связи U0 оказывается порядка 0,01 – 0,1 эВ (2 – 20 кДж∙моль–1).
Несмотря на то, что энергия связи, которая обусловлена действием сил Ван-дер-Ваальса, достаточно мала, эти силы оказываются иногда единственными силами, которые могут обеспечить связь между частицами. Так, силы Ван-дер-Ваальса удерживают атомы в кристаллах инертных газов. Благодаря действию этих сил притягиваются друг к другу молекулы во многих молекулярных кристаллах органических веществ. Действием сил Ван-дер-Ваальса объясняется и налипание (адсорбция) атомов или молекул из газовой или жидкой фазы на поверхность твердых тел.
К сожалению, область расстояний R между атомами или молекулами, соответствующая минимуму их энергии (3.26) нехимического взаимодействия, относится к области средних расстояний. Поэтому простые аналитические выражения, полученные нами для энергии отталкивания (раздел 1) и энергии притяжения частиц (раздел 2) оказываются непригодными для расчетов энергии связи U0, обусловленной действием сил Ван-дер-Ваальса. В области средних расстояний между частицами полная энергия (3.26) нехимического взаимодействия (как, впрочем, и химического) может быть рассчитана только численными методами, путем решения соответствующих уравнений квантовой механики, либо по эмпирическим формулам, полученным на основе экспериментальных данных.
В качестве примера такой формулы можно привести так называемый потенциал Ленарда-Джонса
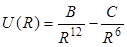 , ,
| (3.30) |
который в области средних расстояний между частицами хорошо описывает зависимость от расстояния полной энергии взаимодействия атомов инертных газов. Первое слагаемое в этой формуле соответствует энергии отталкивания атомов, второе – энергии притяжения, обусловленного действием сил Ван-дер-Ваальса.
Постоянные B и C – это эмпирические параметры, определяемые из независимых измерений, сделанных в газовой фазе. Используемые данные включают вязкость, а также вириальные коэффициенты, которые описывают отклонения в поведении реальных инертных газов от поведения идеального газа.
Для описания изменения потенциальной энергии отталкивания с расстоянием широко используются и другие эмпирические формулы, в частности, формула 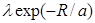 , где эмпирическими параметрами являются постоянные l и a. Формулу, содержащую экспоненту, так же легко обрабатывать аналитически, как и формулу, содержащую обратную степенную функцию.
, где эмпирическими параметрами являются постоянные l и a. Формулу, содержащую экспоненту, так же легко обрабатывать аналитически, как и формулу, содержащую обратную степенную функцию.
[1] Данные взяты из книги
П. Эткинс «Физическая химия» (в 2-х томах), - М.: Мир, 1980.
|
из
5.00
|
Обсуждение в статье: Полная энергия взаимодействия атомов и молекул |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

