 |
Главная |
Тема 7. Электролиты. рН
|
из
5.00
|
Введение: На самом деле, хорошо помогает справляться с этим - осознать теорию Бренстеда-Лоури. Кислота – отдает (донор) Н+, основание – присоединяет Н+, но эта теория настолько проста и охватывает все разделы, что понять ее не получается. Еще нужен список «Сильные и слабые кислоты и основания». Это тайное знание информация есть где то в таблице голубой методичке. Всегда спрашивайте себя, что за хуйню электролит я вижу? Важнейшим навыком в этой теме является способность отличать виды электролитов друг от друга. На всякий случай, приведу это тут:
| Тип | Пример | Среда |
| 1. Сильная кислота | H2SO4, HNO3, HCl… | Кислая, рН<7 |
| 2. Сильное основание | КОН, NaOH, LiOH, Ba(OH)2… | Щелочная, рН>7 |
| 3. Соль сильное основание + сильная кислота | KNO3, NaCl, Li2SO4… | Нейтральная, рН=7 |
| 4. Слабая кислота | HNO2, H2CO3, H3PO4, H2S… | Кислая, рН<7 |
| 5. Слабое основание | NH3, CH3NH2, Cu(OH)2, Fe(OH)3… | Щелочная, рН>7 |
| 6. Соль сильное основание + слабая кислота | KNO2, CH3COONa, Li2CO3… | Щелочная, рН>7 |
| 7. Соль слабое основание + сильная кислота | NH4Cl, [CH3NH3]2SO4… | Кислая, рН<7 |
| 8. Соль слабое основание + слабая кислота | Fe2S3, (NH4)2CO3… | Нейтральная, рН≈7 |
Всегда держите в голове, что есть кислоты сильные, есть слабые, есть основания сильные, есть слабые, а соли – продукты их взаимодействия – образованы кислотой (сильной или слабой) и основанием (тоже сильным или слабым). Ахтунг!!! Если вы не поняли то, попытки решить эти задачи бессмысленны.
Типичные вопросы:
1. Какие свойства – кислоты, основания или и те и те – проявляет частица
Пример:
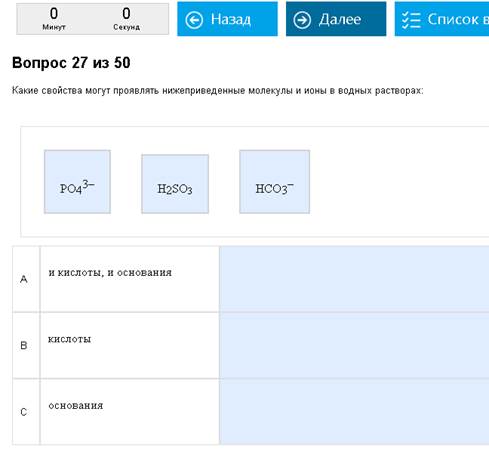
Кислоты и основания…
Как с этим бороться:
Вроде и просто, а вроде и сложно. Кислота может отдать Н+, а основание принять его. Соответственно, чтобы отдать Н+, его нужно предварительно иметь. Кислота – это что то с Н, способное его отрывать (Н2S, HS, H3PO4, H2PO4, HPO4, NH4+… то есть или кислоты с хотя бы 1 Н, или слабые основания с присоединенным лишним Н) а основания – обычно что-нибудь с «-», чтобы лучше присоединять Н+, хотя и не обязательно. (Хорошие основания = полностью обезводороженые остатки кислот или собственно разные основания ОН, NH3, CO3, PO4)
2. Расположить вещества в порядке возрастания/убывания рН
Пример:

Ряд разных электролитов. Представлены, уже верно расположенные по возрастанию рН: сильная двухосновная кислота (H2SO4), сильная одноосновная кислота (HNO3), соль слабого основания и сильной кислоты (Al2(SO4)3), слабое основание (NH3).
Как с этим бороться:
Тут может хорошо помочь шкала электролитов по возрастанию рН:
Сильная двухосновная кислота (H2SO4) >
сильная одноосновная кислота (HCl) >
слабая кислота (список) >
соль сильной кислоты и слабого основания >
соль сильной кислоты и сильного основания >
соль сильного основания и слабой кислоты >
слабое основание (список) >
сильное одноосновное основание (KOH, NaOH…) >
сильное двухосновное основание (Ba(OH)2)
Смотрим, какие у нас 4 электролита, определяем их тип и располагаем в соответствии со шкалой.
3. Соотнесите вещества с цифрами рН.
Пример:

Суровые электролиты.
Как с этим бороться:
Аналогично предыдущему вопросу, но вместо порядка возрастания-убывания надо соотносить с цифрами рН. Самый кислый электролит соотносят с самой маленькой из данных цифр и далее идут по возрастанию. Определяйте тип электролитов грамотно, не путайте соли с кислотами, а сильные кислоты со слабыми кислотами.
4. Соотнести вещества с областями рН.
Пример:

Области рН. Электролиты в порядке как даны: соль сильного основания и слабой кислоты, слабая кислота, соль слабого основания и слабой кислоты.
Как с этим бороться:
Даже легче, чем предыдущие вопросы. Определяем тип электролитов опять, и из табл узнаем, у какого электролита какая область рН.
5. Гидролиз солей.
Пример:

И тут тоже номенклатура, уже неорганических веществ. Ну что за твою мать?.
Как с этим бороться:
А вот так:
| Тип | Гидролиз | Среда |
| 1. Соль сильное основание + сильная кислота | Нет | Нейтральная, рН=7 |
| 2. Соль сильное основание + слабая кислота | По аниону | Щелочная, рН>7 |
| 3. Соль слабое основание + сильная кислота | По катиону | Кислая, рН<7 |
| 4. Соль слабое основание + слабая кислота | И по катиону, и по аниону | Нейтральная, рН≈7 |
Определили тип электролита (умеем же?), и автоматом определяется тип гидролиза. Сильно запутывает ситуацию то, что соли даны через названия. Вспоминаем, что такое есть сульфат, сульфит и сульфид, и прочие радости ЕГЭшно-школьной жизни.
6. Неизвестный тип задачи.
Пример:
?
нет.
Как с этим бороться:
Пока неизвестно.
|
из
5.00
|
Обсуждение в статье: Тема 7. Электролиты. рН |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

