 |
Главная |
Тема 4.3. Титриметрический метод анализа. Физико-химические методы анализа
|
из
5.00
|
Сущность титриметрического метода анализа. Методы определения эквивалентной точки. Способы выражения концентраций. Определение эквивалентных масс. Расчеты в титриметрическом методе анализа.
Метод нейтрализации. Сущность метода. Индикаторы. Рабочие растворы, их приготовление. Применение метода в анализе пищевых продуктов.
Физико-химические методы анализа.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Титриметрический (объемный анализ) – метод количественного анализа, где искомое вещество определяют по объему реактива с точно известной концентрацией, затраченной на реакцию с этим веществом. По сравнению с гравиметрическим, объемный анализ требует меньшей затраты времени, но уступает в точности. При определении объемным методом, к известному объему раствора определяемого вещества, малыми порциями (по каплям) добавляют реактив с точно известной концентрацией до тех пор, пока его количество не будет эквивалентно количеству определяемого вещества. Раствор реактива с точно известной концентрацией называют рабочим, стандартным или титрованным.
Основной операцией любого метода объемного анализа является титрование. Титрованием называют приливание одного раствора к другому с целью определения концентрации одного из них, если известна концентрация другого. При титровании необходимо соблюдать следующие условия:
- реакция между реагирующими веществами должна быть необратимой и проходить количественно до конца.
- конец реакции (точка эквивалента) должна четко фиксироваться каким-либо внешним признаком, это достигается с помощью индикатора.
- вещества, которые находятся в растворе вместе с определяемым не должны мешать течению основной реакции.
В объемном анализе различают:
- окислительно-восстановительный метод.
- метод осаждения и комплексообразования.
Пользуясь данными методами в лабораторной практике можно исследовать качество I, II блюд, закусок и т.д.
Формулы для вычислений в объемном анализе
Q = T * V; или T =  ;
;
T =  ; или H =
; или H =  .
.
Согласно закону эквивалентов на титрирование 1 г-экв любого вещества будет израсходовано 1 г-экв другого вещества. Из этого вытекает правило:
Объем двух растворов разных веществ (кислот и щелочей) реагирует между собой в количествах обратно пропорциональным их нормальностям.
 =
=  или V1 =
или V1 = 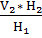
Вычисления в объемном анализе
Условные обозначения
М – молекулярная масса
Э – эквивалент
V – объем раствора
Т – титр раствора
Н – нормальная концентрация
Q – количество определяемого вещества
г-экв – грамм-эквивалент
С г/л – количество грамм вещества в 1 литре.
В объемном анализе концентрацию веществ выражают числом эквивалента вещества, содержащегося в одном литре раствора, т.е. его нормальностью. обозначается буквой – Н.
Т – титр показывает, какое количество грамм вещества растворено в 1 мл. С точки зрения нормальности, растворы могут быть деценормальными и сантинормальными (0,1; 0,2 или 0,01; 0,02; 0,03). Эквивалент записывается буквой Э и рассчитывается по формуле:
1. Для кислот: Эк-т =  ;
;
Например: ЭH2SO4 =  =
=  = 49
= 49
2. Для оснований: Эосн. =  ;
;
Например: ЭNaOH = 40
3. Для солей: Эсоли =  ;
;
Например: ЭAl2(SO4)3 =  = 57
= 57
Между нормальностью и титром существует зависимость. Зная нормальность можно рассчитать титр и наоборот.
Т =  или Н =
или Н = 
Растворы разной концентрации реагируют между собой в объемных количествах, обратно пропорционально их нормальности.
Q = T * V; T = 
 =
=  или V1 * H1 = V2 * H2
или V1 * H1 = V2 * H2
или Нк = 
Vк = 
Зная объемы растворов и нормальность одного из них, пользуясь уравнением:
 =
= 
можно рассчитать нормальность другого вещества
Нщ =  .
.
Задача:
Сколько граммов нитрата серебра потребуется для приготовления 1,5 л 0,1 Н раствора?
Решение:
| Q = ? V = 1,5 л Н = 0,1 | Q = T * V
ЭAgNO3 = М = 170
T =  ; T = ; T =  = 0,017 г/мл
Q = 0,017 * 1,5 = 0,0255 г. = 0,017 г/мл
Q = 0,017 * 1,5 = 0,0255 г.
|
ПОСЛЕ ИЗУЧЕНИЯ ТЕМЫ ОБУЧАЮЩИЙСЯ ДОЛЖЕН ЗНАТЬ И УМЕТЬ:
- Сущность и разновидности объемного анализа, вычисления в объемном анализе.
- Метод нейтрализации, его сущность, индикаторы, рабочие растворы.
- Уметь определять титр, нормальность и количество вещества.
ВОПРОСЫ ДЛЯ КОНТРОЛЯ:
1. В чем сущность объемного анализа? Какие разновидности объемного анализа различают?
2. Перечислите, какие Вы знаете важнейшие условия для правильного проведения объемно-аналитических определений?
3. В чем сущность метода нейтрализации? Какая химическая реакция лежит в основе этого метода?
4. Что такое стандартный или титрованный раствор?
5. Вычислить титр 0,1096 Н раствора HCl (ответ: 0,0040 г/мл).
6. 50 мл раствора H2SO4 неизвестной концентрации реагирует нацело с 45,6 мл 0,1 Н NaOH. Какова нормальность раствора?
РАЗДЕЛ 5. ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ.
Тема 5.1. Вступление. Основные понятия и законы термодинамики. Термохимия.
Предмет и задачи физической и коллоидной химии. Термодинамика.
Термохимия. Тепловой эффект реакции при постоянном давлении, измеряемый изменением энтальпии, термохимические уравнения, теплота (энтальпия) образование и разложение· Теплота сгорания. Теплота растворения. Основные законы термохимии.
Термохимические расчеты, их значение в энергетике биохимических и физиологических процессов.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Физическая химия – это наука, изучающая связь химических и физических свойств веществ, физических и химических явлений и процессов.
Для теоретических обобщений и практических выводов физическая химия широко используется термодинамическим методом исследования, который дает точные соотношения между энергией и свойствами систем. Химическая термодинамика изучает взаимные переходы химической энергии в другие формы энергии, энергетические эффекты химических процессов, их зависимость от внешних условий, а также возможность и направление химических реакций при заданных свойствах.
Необходимо усвоить некоторые понятия и термины, используемые при изучении раздела «Термодинамика».
В термодинамике под системой понимают вещество или группу взаимодействующих веществ, фактически или мысленно обособленных от окружающей среды. Тела, находящиеся за пределами термодинамической системы, называют окружающей средой.
К изолированным относятся системы, которые не обмениваются массой и энергией с внешней средой. Системы бывают гомогенными (однофазными), обладающими одинаковыми физическими свойствами и химическими в любой части объема, например, воздух, раствор хлорида калия, раствор поваренной соли без осадка. Гетерогенной системой называет систему, состоящую из различных фаз. Так, системы: насыщенный раствор соли - твердая соль, лед - пар, жидкая вода - пар являются гетерогенными (разнородными) системами. Характерной чертой таких систем будет наличие в них поверхностей, отделяющих одну фазу от другой - граница раздела фаз, например, растительное масло с водой, супы, щи, борщи. Состояние системы описывается термодинамическими параметрами – температурой, давлением, объемом, концентрацией, внутренней энергией.
Параметры состояния системы связаны между собой соотношением, которое называется уравнением состояния. Для n молей идеального газа уравнением состояния является уравнение Менделеева-Клайперона:
PV= nRТ
Изменение термодинамических параметров состояния системы приводит к возникновению термодинамического процесса. Если термодинамические параметры с течением времени самопроизвольно не изменяются и сохраняют одинаковые значения в пределах каждой фазы, то состояние является равновесным. Состояния, характеризуемые неравномерным и изменяющимся во времени распределением температуры, давления и состава внутри фаз, относятся к неравновесным.
Различные термодинамические процессы, протекающие при постоянной температуре, называются изотермическими, при постоянном давлении - изобарными (например, в автоклаве, приготовление пищи в скороварке), при постоянном объёме - изохорными.
Все тела (термодинамические системы) в природе независимо от агрегатного состояния обладают определенным запасом внутренней энергии, представляющей собой сумму энергий, движение всевозможных частиц, из которых они состоят, молекул, ионов, атомов, электронов, протонов, и т.д.
Изучите законы термодинамики. Первый закон термодинамики является постулатом и не доказывается логическим путем.
ПОСЛЕ ИЗУЧЕНИЯ ТЕМЫ ОБУЧАЮЩИЙСЯ ДОЛЖЕН ЗНАТЬ И УМЕТЬ:
- Содержание и задачи физической и коллоидной химии.
- Основные понятия термодинамики.
- Термохимия, законы термохимии.
- Объяснять понятие термодинамики.
- Объяснять суть законов термодинамики и термохимии.
- Записывать математическое выражение законов термодинамики и термохимии.
- Производить расчеты на основании закона Гесса и следствия из него.
ВОПРОСЫ ДЛЯ КОНТРОЛЯ:
1. Приведите примеры гомогенных и гетерогенных систем из технологии приготовления пищи.
2. Дайте математическое выражение первого закона термодинамики и объясните содержание входящих в него величин.
3. Приведите примеры экзо- и эндотермических реакций.
4. Какие уравнения называются термохимическими и почему в них могут быть дробные коэффициенты?
5. Что называется тепловым эффектом реакции, и в каких единицах он выражается?
6. Как формулируется закон Гесса?
|
из
5.00
|
Обсуждение в статье: Тема 4.3. Титриметрический метод анализа. Физико-химические методы анализа |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

