 |
Главная |
Статистический смысл II начала термодинамики
|
из
5.00
|
Состояние макросис. м.б. задано параметрами p, V, T, ν и др. Можно задать состояние всех молекул (их скор., энергии, корд.), тогда такое детальное описание макросистемы называют микросостоянием.
Любое макросост. системы м.б. реализовано различными способами, каждому из них соответств. некоторые микросист. Число различных микросостояний, соответствующих данному макросост., наз. статистическим весом макросостояния.
В качестве примера рассмотрим способы, которыми могут распределяться N = 4 молекулы между двумя половинами сосуда с газом (без учета распр. Максв.). Вероятность того, что любая из молекул может нах. в половине А равна 1/2. Вероятность одновр. пребывания одной и другой 1/2·1/2 = 1/22 (независ. события) трех 1/23 чет – 1/24. Вероятность любого размещ. 4-х молекул также равна 1/24. Каждое размещение – микросостояние системы и вероятность всех микросостояний одинакова и равна 1/24. Всех возможных распределений 4-х
| |
| |

 | |||||||||
 |  | ||||||||
| | |


| Макросостояния | Способы реализации макросостояний | Микросостояния | |||
| А | В | А № молекул | В № молекул | Число способов Ω | Обычная вероятность Р |
| - | 1,2,3,4 | 1/16 | |||
| 2 3 4 1 3 4 … 1 2 3 | 4/16 | ||||
| 1,2 1,3 1,4 2,3 2,4 3,4 | 3,4 2,4 2,3 1,4 1,3 1,2 | 6/16 | |||
| 1 2 3 1 2 4 1 3 4 2 3 4 | 4/16 | ||||
| 1 2 3 4 | - | 1/16 |
Всего микро состояний – 16 = 24
Макросостояние – это состояние, при котором в половине А сосуда: находится, например одна молекула (любая), а в половине В – три молекулы. Такие состояния реализуется 4-мя способами. Статический вес данного макросостояния равен 4, а вероятность 4/16.
Макросостояние с 2-мя молекулами в каждой из половин, реализуется с помощью 6 микросостояний и его статистический вес (Ω=6) и вероятность этого макростояния максимальна, т.е., плотность газа выравнивается.
Предположим, что вначале все молекулы находились в половине А, затем некоторые из молекул, двигаясь беспорядочно, перейдут в В, что означает, что «газ расширился». Далее макросостояние системы будет меняться случайным образом, но чаще будет реализоваться то из них, которому соответствует максимальное Ω, т.е. более вероятное. Может произойти так, что все четыре молекулы снова окажутся в половине А, т.е. газ самопроизвольно сожмется. Т.е. процесс расширения станет обратимым. Однако, вероятность такого события  для 4х молекул и р=
для 4х молекул и р= 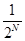 для N молекул. Если в сосуде N=100 молекул, то p » 10-30 .
для N молекул. Если в сосуде N=100 молекул, то p » 10-30 .
Такова вероятность, что газ самопроизвольно сожмется. А вероятность того, что молекулы равномерно распределятся по объему, растет с N. Таким образом, отсюда следует важный вывод: предоставленная самой себе
макросистема стремится перейти от менее вероятных состояний к более вероятным. Это является причиной необратимости т. процессов. Т. е. обратимый процесс, в принципе, возможен, но его вероятность ничтожно мала.

2-ой закон термодинамики. указывает на необратимость перехода работы (механической энергии) в тепло, поскольку обратный переход – теплоты в работу означает переход от более вероятного состояния к менее вероятному.
В состоянии равновесия число молекул в обоих половинах сосуда можно считать одинаковым при большом N.
|
из
5.00
|
Обсуждение в статье: Статистический смысл II начала термодинамики |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

