 |
Главная |
Идеальный газ. Уравнение состояния
|
из
5.00
|
Молекулярная физика и
Термодинамика
сборник методических указаний
для самостоятельной работы студентов БГИТА
дневного и заочного обучения
Брянск 2005
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное агентство по образованию
Брянская государственная инженерно-технологическая академия
Кафедра физики
УТВЕРЖДЕНО
Редакционный совет БГИТА
Протокол №___ от "__"________г.
Молекулярная физика и
Термодинамика
сборник методических указаний
для самостоятельной работы студентов БГИТА
дневного и заочного обучения
Брянск 2005
Составители: ст. преподаватель кафедры физики БГИТА, Матанцева В.А.
ассистент кафедры физики БГИТА Притыченко Л.М.
Рецензент: зав. кафедрой математики, доцент, к.ф-м.н. Баранова И.М.
Рекомендованы редакционно-издательской комиссией
строительного факультета
Протокол № ___ от " __" _________г.
Содержание
| Стр. | |
| Введение……………………………………………………………. | |
| 1. Идеальный газ. Уравнение состояния Идеального Газа. Газовые законы………………………………………… | |
| 2. Изопроцессы в Идеальном Газе………………………… | |
| 3. Основы молекулярно – кинетической теории газов……………………………………………………………………… | |
| 4. Явления переноса в термодинамических неравновесных системах…………………………………………….…. | |
| 5. Основы термодинамики…………………………………... | |
| 6. Круговые процессы. Цикл Карно……………………….. | |
| 7. ЭНТРОПИЯ. II И III НАЧАЛА ТЕРМОДИНАМИКИ…………… | |
| 8. Реальные газы. Жидкости …………………………………. | |
| 9. Примеры решения задач……………………………………. | |
| 10. Литература……………………………………………………… |
Введение
Любое тело с точки зрения молекулярной физики можно представить как совокупность огромного числа частиц. Поэтому описывать свойства такого тела – системы частиц - целесообразно с помощью усредненных значений физических величин – скорости, импульса, энергии. Вместе с тем, систему как целое можно характеризовать такими понятиями как масса, количество вещества, давление, температура, внутренняя энергия и т.д.
В любом случае описание и исследование свойств системы частиц удобно проводить с помощью модели термодинамической системы, характеризуемой термодинамическими параметрами.
Идеальный газ. Уравнение состояния
Идеального Газа. Газовые законы
Простейшей моделью термодинамической системы является идеальный газ.
Идеальным газом называют газ, в котором: собственные размеры молекул пренебрежимо малы по сравнению с размером сосуда; отсутствует взаимодействие между молекулами (т.е. потенциальная энергия взаимного притяжения молекул пренебрежимо мала); соударения молекул со стенками сосуда – абсолютно упругие.
Идеальный газ (как и любое вещество) можно характеризовать величинами:
-количество вещества  ;
; 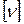 = моль;
= моль;
 ; или
; или  ; или при нормальных условиях
; или при нормальных условиях  ;
;
где: N – общее число молекул в данной системе;  - постоянная Авогадро (число частиц в одном моле вещества);
- постоянная Авогадро (число частиц в одном моле вещества);  - масса данной системы;
- масса данной системы;  - молярная масса вещества (см. ниже);
- молярная масса вещества (см. ниже); 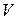 - объем, занимаемый веществом;
- объем, занимаемый веществом;  - объем одного моля вещества;
- объем одного моля вещества;
При нормальных условиях 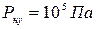 и
и 
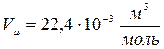 ;
;
 - молярная масса вещества;
- молярная масса вещества;  ;
;
 ;
;
где:  - относительная молекулярная масса, определяемая по химической формуле вещества;
- относительная молекулярная масса, определяемая по химической формуле вещества;  - размерный коэффициент в системе СИ.
- размерный коэффициент в системе СИ.
Также  .
.
Для смеси газов 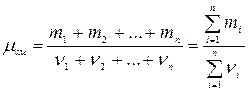 ;
;
где  и
и 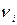 - соответственно масса и количество вещества i-того компонента смеси; n – число компонентов смеси.
- соответственно масса и количество вещества i-того компонента смеси; n – число компонентов смеси.
Массовая доля i-того компонента смеси
 ,
,
где  - масса смеси.
- масса смеси.
Термодинамическими параметрами идеального газа являются объем, давление и температура.
Объемомназывается часть пространства, занимаемая телом
Для термодинамической системы (идеального газа) объемом может служить объем сосуда, в котором она находится.  ;
; 

Давление – скалярная физическая величина, численно равная силе, приходящейся на единицу площади поверхности, на которую эта сила нормально действует:
 ;
;  = Па (паскаль)
= Па (паскаль)
Для термодинамической системы давление обусловлено совокупным действием молекул на дно и стенки сосуда.
Для смеси газов справедлив закон Дальтона:
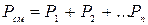 ,
,
где  - парциальное давление i-го компонента смеси; n – число компонентов смеси.
- парциальное давление i-го компонента смеси; n – число компонентов смеси.
Температура – мера интенсивности теплового движения частиц системы, находящейся в равновесном состоянии.
 (кельвин) - по термодинамической температурной шкале.
(кельвин) - по термодинамической температурной шкале.
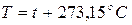 - взаимосвязь между термодинамической и стоградусной шкалой Цельсия.
- взаимосвязь между термодинамической и стоградусной шкалой Цельсия.
Уравнение, связывающее термодинамические параметры, является уравнением состояния термодинамической системы. Основным уравнением состояния ИГ является уравнение Менделеева-Клапейрона:
 (1.1)
(1.1)
где:  - универсальная газовая постоянная.
- универсальная газовая постоянная.
Домножив и поделив левую часть (1.1) на  , а также поделив на V, получим:
, а также поделив на V, получим:
 (1.2)
(1.2)
где: 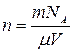 - концентрация молекул;
- концентрация молекул;  - постоянная Больцмана
- постоянная Больцмана
|
из
5.00
|
Обсуждение в статье: Идеальный газ. Уравнение состояния |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

