 |
Главная |
Неравновесных системах
|
из
5.00
|
В термодинамически неравновесных системах хаотическое движение молекул, их перемешивание приводит к выравниванию неравновесности той или иной величины. При этом происходят особые необратимые процессы - явления переноса: диффузия, теплопроводность, внутреннее трение (вязкость)
Диффузия – направленный перенос массы, обусловленный пространственной неоднородностью (градиентом) плотности. Диффузия описывается законом Фика:
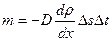 (4.1)
(4.1)
где: m – масса вещества, переносимая в процессе диффузии за время  перпендикулярно площадке
перпендикулярно площадке  в направлении меньшего значения плотности
в направлении меньшего значения плотности  ;
; 
 - пространственная неоднородность (градиент) плотности; D – коэффициент диффузии;
- пространственная неоднородность (градиент) плотности; D – коэффициент диффузии;  , где
, где  - средняя длина свободного пробега молекул, т.е. путь, проделанный молекулой между двумя последовательными столкновениями;
- средняя длина свободного пробега молекул, т.е. путь, проделанный молекулой между двумя последовательными столкновениями;  - средняя скорость теплового движения молекул.
- средняя скорость теплового движения молекул.
Теплопроводность – направленный перенос количества теплоты, обусловленный неоднородностью температуры. Теплопроводность описывается законом Фурье:
 (4.2)
(4.2)
где: Q – количество теплоты, переносимое за время  перпендикулярно площадке
перпендикулярно площадке  в направлении меньшего значения температуры T;
в направлении меньшего значения температуры T; 
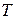 - пространственная неоднородность (градиент) температуры;
- пространственная неоднородность (градиент) температуры;  - коэффициент теплопроводности;
- коэффициент теплопроводности; 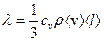 ;
;  - удельная теплоемкость при постоянном объеме V;
- удельная теплоемкость при постоянном объеме V;  - плотность.
- плотность.
Внутреннее трение или вязкость – направленный перенос импульса, обусловленный пространственной неоднородностью скорости. Внутреннее трение описывается законом Ньютона:
 (4.3)
(4.3)
где р – величина импульса, передающегося за время  перпендикулярно площадке
перпендикулярно площадке  в сторону меньшего значения скорости v;
в сторону меньшего значения скорости v; 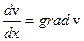 - пространственная неоднородность (градиент) скорости в направлении, перпендикулярном направлению движения слоев;
- пространственная неоднородность (градиент) скорости в направлении, перпендикулярном направлению движения слоев;  - коэффициент динамической вязкости
- коэффициент динамической вязкости 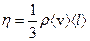
Все три коэффициента связаны между собой: 
 .
.
Основы термодинамики
Внутренняя энергия U термодинамической системы – это энергия теплового движения молекул и энергия их взаимодействия. Так как в идеальном газе взаимодействие пренебрежимо мало, то под внутренней энергией идеального газа понимают только энергию движения. Из молекулярно-кинетической теории известно, что энергия теплового движения зависит только от температуры данного состояния системы:
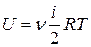 ;
;
 или
или  (5.1)
(5.1)
где i - число степеней свободы молекул.
Числом степеней свободы молекул называется число независимых координат, характеризующих положение молекулы в пространстве. Так как при хаотическом движении молекулы могут двигаться поступательно, вращательно, а также при очень высоких температурах совершать колебания вокруг положения равновесия, то и координаты, а, следовательно – степени свободы могут, быть соответственно поступательными, вращательными, колебательными.
Для одноатомных молекул i = 3 - поступательные степени свободы; для двухатомных: i = iпост + iвращ = 3 + 2 = 5; для трех- и многоатомных: i = 3 + 3 = 6 степеней свободы при наличии колебательного движения добавляются 6 колебательных степеней свободы.
Независимо от общего числа степеней свободы ни одна из них не имеет преимущества перед другими. На каждую степень свободы приходится одинаковая энергия:
 . (5.2)
. (5.2)
Потому, полная энергия движения молекулы определяется числом ее степеней свободы i
 , (5.2 а)
, (5.2 а)
где k – постоянная Больцмана.
Работа термодинамической системы против внешних сил всегда есть работа по изменению объема системы:
 (5.3)
(5.3)

Для изопроцессов:
1)  ;
; 
2)  ;
; 
3) 

4) 

Изменение ∆U внутренней энергии может происходить по двум причинам:
а) при сообщении системе некоторого количества теплоты Q, тогда Q = ∆U
б) при совершении над системой внешними силами работы AВН, тогда AВН = ∆U
При наличии обоих факторов
∆U = Q + AВН
Однако при внешнем воздействии термодинамическая система способна совершить собственную работу против внешних сил A = - AВН Поэтому можно записать
Q = ∆U + A (5.4)
Это выражение является законом сохранения энергии в термодинамике и называется I-м началом термодинамики.
В применении к изопроцессам этот закон принимает вид:
1) 
2) 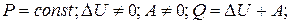
3) 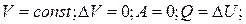
4) 
Под теплоемкостью понимают также физическую величину, равную отношению некоторого количества теплоты, необходимого для нагревания тела на один градус.

где: Q - количество теплоты, сообщаемое телу; ΔТ - изменение температуры тела в термодинамическом процессе.
Различают:
 - удельная теплоемкость (теплоемкость единицы массы)
- удельная теплоемкость (теплоемкость единицы массы) 
 - молярная теплоемкость (теплоемкость единицы количества вещества)
- молярная теплоемкость (теплоемкость единицы количества вещества) 
Связь между с и  :
:
 ,
,
где:  - молярная масса вещества.
- молярная масса вещества.
Различают также CP и CV – молярные теплоемкости при постоянном давлении и постоянном объеме соответственно.
 (5.5)
(5.5)
где: i – число степеней свободы молекул термодинамической системы.
Соответственно, удельные теплоемкости:
 (5.6)
(5.6)
Теплоемкости CP и CV связаны уравнением Майера:
 (5.7)
(5.7)
Уравнение Майера является выражением I-го начала термодинамики для 1 моля вещества и, следовательно,  имеет физический смысл термодинамической работы 1 моля вещества при сообщении ему количества теплоты в изобарном процессе.
имеет физический смысл термодинамической работы 1 моля вещества при сообщении ему количества теплоты в изобарном процессе.
Отношение  называется адиабатической постоянной, или показателем Пуассона.
называется адиабатической постоянной, или показателем Пуассона.
 (5.8)
(5.8)
Для одноатомных газов: (i = 3), 
Для двухатомных газов: (i = 5), 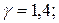
Для 3-х и многоатомных газов: (i = 6), 
|
из
5.00
|
Обсуждение в статье: Неравновесных системах |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

