 |
Главная |
Современная рациональная классификация аминокислот
|
из
5.00
|
в соответствии с ней все аминокислоты делятся на 4 группы.
I – Неполярные гидрофобные аминокислоты – их 8.

| Аланин Валин Лейцин Изолейцин Триптофан |
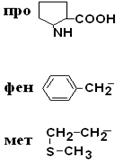
| Пролин Фенилаланин Метионин |
II –Полярные гидрофильные незаряженные аминокислоты – их 7.

| Глицин Серин Треонин Цистеин |
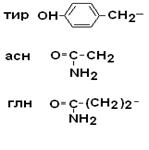
| Тирозин Аспарагин Глутамин |
III – Отрицательно заряженные кислые аминокислоты

| Аспарагиновая кислота |

| Глутаминовая кислота |
IV Положительно заряженные основные аминокислоты

| Лизин Аргинин |
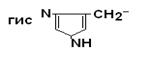
| Гистидин |
Образование пептидных связей.
a–СООН группа одной аминокислоты может реагировать с a–NH2 группой другой аминокислоты с образованием пептидных связей.

|
Пептидные цепи белков – это линейные полимеры a–АК, соединенных пептидной связью.
Мономеры аминокислот, входящих в состав полипептидов, называются аминокислотными остатками, цепь повторяющихся групп –NH–CH–CO– называется пептидным остовом. Аминокислотный остаток, имеющий свободную NH2–группу называется N–концевым, а имеющий свободным α–карбоксигруппу – С–концевым.
Пептиды пишутся и читаются с N–конца.
Пептидная связь, образуемая аминогруппой пролина, отличается от других пептидных связей: у атома азота пептидной группы отсутствует водород, вместо него имеется связь с R.

Пептидные связи очень прочные, для их неферментного гидролиза in vitroтребуются жесткие условия: высокие t° и r, кислая среда, длительное время. In vivo, где нет таких условий, пептидные связи могут разрываться с помощью протеолитических ферментов (E), называемых протеазами или пептидгидролазами.
Полипептидная теория строения белков была предложена в 1902 г. Э.Фишером, в ходе дальнейшего развития биохимии эта теория была экспериментально доказана.
Экспериментальные доказательства полипептидного
строения белков
1. Титруются только концевые COOH– и NH2– группы.
2. При гидролизе белков образуется стехеометрическое количество титруемых COOH– и NH2–групп (происходит распад определенного числа пептидных связей).
3. Под действием протеолитических ферментов (протеаз) белки расщепляются на строго определенные фрагменты с концевыми аминокислотами, соответствующими избирательному действию протеаз.
4. Биуретовую реакцию (раствор сульфата меди CuSO4 в щелочной среде – сине-фиолетовое окрашивание) дают и биурет (NH2–CO–NH–CO–NH2), содержащий пептидную связь и белки.
5. Проведенный рентгеноструктурный анализ (разрешительная способность 0,15-0,2 нм) показывает на рентгенограмме пептидную связь.
6. Самое убедительное доказательство – это синтез химическими методами белков с уже расшифрованной структурой. Синтезированные белки обладают физико-химическими свойствами и биологической активностью, аналогичными природным белкам .
ЛЕКЦИЯ 2
Классификация белков
В зависимости от химического состава белки делятся на 3 группы:
1) простые (протеины);
2) пептиды;
3) сложные (протеиды).
1. Простые белки построены из аминокислот и при гидролизе распадаются только на аминокислоты.
Протамины и гистоны – содержат до 85% аргинина, поэтому имеют выраженные основные свойства.
Белок сальмин, полученный из молок семги; клупеин – из молок сельди, скорее относятся к пептидам, т.к. имеют Mr не более 5000 Да.
Протамины в основном являются белковой частью нуклеотидов (ДНК). Гистоны сосредоточены главным образом в ядре и представляют белковую часть РНК.
Проламины и глютелины – белки растительного происхождения: зеин получают из кукурузы, глютенин - из пшеницы. Содержат до 25% глу, 10-15% про.
Альбумины и глобулины – содержатся в сыворотке крови, молоке, яичном белке, мышцах и т.д. Это глобулярные белки, отличающиеся различной растворимостью (альбумины растворяются лучше), по Mr (альбумины имеют молекулярную массу, равную 69000 Да, глобулины - 150000Да).
2. Пептиды – это низкомолекулярные азотсодержащие соединения, состоящие из остатков аминокислот и имеющие молекулярную массу менее 5000 Да.
а) с гормональной активностью (АКТГ, окситоцин, вазопрессин и др.);
б) участвующие в процессах пищеварения (секретин, гастрин);
в) содержащиеся в α2-глобулярной фракции сыворотки крови (брадикинин, ангиотензин);
г) нейропептиды (рилизинг-факторы гормонов, например нейрофизины I и II гипоталамуса, способствуют выделению гормонов окситоцина и вазопрессина).
3. Сложные белки или протеиды – состоят из двух частей: белковой и небелковой. Небелковую часть называют простетической группой, а белковую часть, утратившую простетическую группу, называют апобелком.
| Название сложных белков | Простетическая группа |
| 1. Хромопротеиды в т.ч. гемопротеиды, флавопротеиды | окрашенный небелковый компонент гемовое железо производное изоаллоксазина ФАД, ФНН |
| 2. Нуклеопротеиды | РНК, ДНК |
| 3. Липопротеиды | липиды |
| 4. Гликопротеиды | олигосахариды, простые сахара |
| 5. Протеогликаны | полисахариды |
| 6. Металлопротеиды | негемовое железо, другие атомы металлов |
Подробно рассмотрим группу гемопротеидов – это Hb и его производное миоглобин (белок мышечной ткани), хлорофиллсодержащие белки и ферменты (цитохромы b, С, С1, каталаза, пероксидаза). Все они в качестве простетических групп содержат Fe (или Mg)–порфирины, а отличаются белковой частью.

Структуру гема впервые раскрыл Ненцкий, а его синтез провел Фишер.
HbA1 – основной представитель Hb крови взрослого человека;
Фетальный HbF – в крови новорожденного содержится до 80%, к концу 1-го года жизни он почти полностью заменяется на HbA1.
HbA состоит из 4 ППЦ: 2α–субъединиц и 2b–субъединиц. Четыре субъединицы или протомера ППЦ гемоглобина связаны друг с другом гидрофобными взаимодействиями. Молекула гемоглобина диссоциирует на два димера - ab и a1b1. Каждый протомер содержит гем, находящийся в гидрофобной «нише», защищающей его от окисления в ферри-форму. Mr ППЦ гемоглобина равна 64458 (64500) Да.


В основе простетической группы Нbлежит протопорфирин, у которогоимеются: в положении 1,3,5,8-СН3– метильный R; в положении 2,4 СН2=СН– винильнный R; в положении 6,7 СООН–СН2–СН2 – остатки пропионовой кислоты. Железо, входящее в состав гемоглобина, имеет 2 ковалентные и 4 координационные связи; четыре связи образуют связи с атомами азота, пятая координационная связь присоединяет кислород к гему, шестая – связывает гем и ППЦ.

|
из
5.00
|
Обсуждение в статье: Современная рациональная классификация аминокислот |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

