 |
Главная |
Технологические карты темы и урока химии (Л.И. Асанова)
|
из
5.00
|
Структура технологической карты темы
| Тема изучения | ||
| Цели | ||
| Основное содержание темы | ||
| Термины и понятия | ||
| Образовательные результаты | ||
| Личностные | Метапредметные | Предметные |
| Познавательные УУД: Регулятивные УУД: Коммуникативные УУД: | ||
| Организация образовательной среды | ||
| Ресурсы | Химический Расчетные эксперимент задачи | Межпредметные Форма связи работы |
| Информационный материал: Интерактивный материал: | Демонстрации Лабораторные опыты Практические работы |
Структура технологической карты урока
Урок 1. Тема урока__
Тип урока __________
| Деятельность учителя | Деятельность учащихся | Формируемые УУД | |||
| Познавательные | регулятивные | коммуникативные | личностные | ||
| I этап _____________________ | |||||
| I I этап _____________________ | |||||
| I I I этап _____________________ |
Образец создания технологической карты урока
Урок 1. Сущность, признаки и условия протекания химических реакций. Тепловой эффект химической реакции
Тип урока Изучение нового материала
| Деятельность учителя | Деятельность учащихся | Формируемые УУД | ||||||||
| познавательные | регулятивные | коммуникативные | личностные | |||||||
| I этап. Актуализация знаний и постановка цели урока | ||||||||||
| Организует деятельность по актуализации понятий "физическое явление" и "Химическое явление". Предлагает ответить на вопросы: - Что такое явление? - Какие группы явлений вы знаете? - В чем главное отличие химических явлений от физических? - Дайте определение, приведите примеры и укажите признаки химических реакций. | Слушают вопросы, во фронтальном режиме отвечают на них, контролируют правильность ответов учащихся. | Давать определение понятиям, обобщать понятия, осуществлять сравнение и классификацию, строить логические рассуждения, устанавливать причинно-следственные связи. Осознанно и самостоятельно строить речевые высказывания. | Слушать в соответствии с целевой установкой, дополнять, уточнять ответы одноклассников по существу поставленного вопроса. | Воспринимать на слух вопросы учителя и ответы учащихся, строить понятные для собеседника речевые высказывания. | Понимать единство естественнонаучной картины мира | |||||
Тема 8. Первоначальные химические понятия. Методика изучения АМУ.
Изучив тему, вы должны
ЗНАТЬ:
· место темы в курсе химии, цели ее изучения;
· содержание первоначальных понятий о веществе, химическом элементе и химической реакции;
· методику формирования понятий о простом веществе и химическом элементе;
· набор химического эксперимента при изучении темы.
УМЕТЬ:
· осуществлять методический анализ темы, планировать систему уроков;
· осуществлять демонстрационный эксперимент по теме;
· решать расчетные задачи темы, составлять алгоритмы решения;
· организовывать ученический эксперимент по теме;
· обучать школьников составлять химические формулы и уравнения;
· формировать первоначальные практические умений школьников
· разрабатывать дидактический материал по теме.
Задания для подготовки к занятию (входной контроль):
1) Раскройте образовательные, воспитательные и развивающие цели преподавания АМУ.
2) Раскройте структуру содержания темы "Первоначальные химические понятия", качественную и количественную стороны входящих в нее понятий.
3) В чем состоит сложность формирования понятия о химическом элементе в сравнении с понятиями о веществе и химической реакции?
4) Как раскрывается сущность химических реакций в свете АМУ?
5) Трудности в разграничении понятий "химический элемент" и "простое вещество", их качественные и количественные характеристики, символика. Предупреждение ошибок школьников.
6) Формирование первоначальных понятий о химическом языке, символике и номенклатуре.
7) Роль пропедевтического курса химии в изучении АМУ.
8) Приведите примеры перспективных методов и дидактических средств для успешного освоения школьниками АМУ.
Литература:
1. Чернобельская Г.М. Методика обучения химии в средней школе.- М.: Владос, 2000, с. 212-220.
Подготовка сообщения: "Химический язык и его роль в обучении химии"
Задания для самостоятельного выполнения:
1. Осуществите методический анализ темы.
2. На основе программ и учебников по физике, природоведению, ботанике определите, какие опорные знания из этих курсов используются при изучении первоначальных химических понятий.
3. Проведите анализ определений первоначальных химических понятий, приведенных в учебнике химии.
4. На каких примерах, приведенных в учебнике химии, изучаются понятия "атом", "молекула", "чистое вещество", "простое вещество", "сложное вещество"? Какие реактивы нужны для демонстрации? Чем их можно заменить? Какие лабораторные опыты следует сделать?
5. Найдите в учебнике примеры, на которых изучаются понятия "химическая реакция", "признаки химических реакций", "условия возникновения химических реакций", "типы химических реакций". Какие для этого нужны реактивы и оборудование? Чем их можно заменить? Какие лабораторные опыты можно выполнить?
6. Какие типы расчетных задач изучаются в этой теме? Приведите примеры.
7. Проведите анализ вопросов и упражнений первой темы учебника химии. Определите, как они помогают закрепить и конкретизировать первоначальные химические понятия.
8. Пользуясь программой и учебником, покажите, с какими приемами и методами лабораторной техники знакомятся учащиеся в этой теме.
9. Пользуясь учебником, определите, какие мыслительные приемы включаются и совершенствуются при изучении темы.
10. Разработайте и предложите разнообразные приемы работы школьников с учебником химии при изучении темы.
11. Ознакомьтесь с инструкциями к лабораторным опытам школьников по данной теме (Приложение 1). Дайте их методический анализ. Продумайте варианты включения ученического эксперимента в уроки химии.
12. Ознакомьтесь с инструкциями к Практическим работам "Правила техники безопасности при работе в химическом кабинете. Приемы обращения с лабораторным оборудованием и нагревательными приборами", "Наблюдения за изменениями, происходящими с горящей свечой, и их описание", "Очистка загрязненной поваренной соли", "Признаки химических реакций". Прокомментируйте их.
13. Объясните и покажите приемы выполнения опыта "Очистка загрязненной поваренной соли" на предмет освоения методики подготовки учащихся к практическому занятию.
14. Ознакомьтесь со средствами наглядности, используемыми при изучении темы. Приведите варианты их применения.
15. Составьте дидактический материал к некоторым урокам по теме для проведения кратковременных самостоятельных проверочных работ.
16. Составьте по выбору развернутый план одного из уроков по теме (например, "Чистые вещества и смеси").
17. На основе изучения дополнительной литературы и опыта учителей составьте картотеку уроков.
18. По литературным источникам познакомьтесь с техникой химического эксперимента по теме: демонстрационные опыты:
а) примеры химических явлений: изменения, происходящие при нагревании сахара, горении парафина и магния;
б) способы разделения смесей: фильтрование, выпаривание, высаливание, дистилляция, использование делительной воронки, разделение смеси хроматографическим методом;
в) признаки и условия течения химических реакций;
г) типы химических реакций;
д) опыты, иллюстрирующие закон сохранения массы веществ;
е) опыты, иллюстрирующие закон постоянства состава веществ: разложение воды электрическим током в приборе И.А. Черняка, синтез воды в эвдиометре с использованием высоковольтного преобразователя «Разряд-I»;
лабораторные опыты:
а) изучение и сравнение физических свойств веществ;
б) примеры физических явлений: плавление парафина, возгонка йода, растворение поваренной соли, выпаривание раствора;
в) примеры химических явлений: прокаливание меди в пламени спиртовки, действие соляной кислоты на мел или мрамор;
г) разложение основного карбоната меди (малахита);
д) замещение меди в растворе хлорида меди (II) железом.
Экспериментальная часть:
Опыт 1. Разложение малахита.
Оборудование и реактивы: штатив с лапкой, спиртовка, две пробирки, пробка с газоотводной трубкой, стакан с водой (для проверки прибора на герметичность), известковая вода, малахит.
Соберите прибор для получения газов, проверьте его на герметичность. Зарядите прибор веществом (малахитом). Укрепите в лапке штатива слегка наклонно, донышко выше отверстия. Конец газоотводной трубки поместите в пробирку, куда налито 1 мл известковой воды (Рис. 1).
По правилам нагревайте пробирку с малахитом. Прекращение выделения газа - признак полного разложения вещества.
!Не прекращая нагревания, уберите пробирку с известковой водой, после чего погасите пламя спиртовки.
Зафиксируйте признаки реакции: изменение окраски вещества, появление капелек воды у отверстия пробирки, выделение газа, помутнение известковой воды.
Задания:
а) Зарисуйте прибор, подпишите его составные части. Сколько химических реакций вы наблюдали?
б) Напишите уравнения происходящий реакций (разложения малахита и взаимодействие углекислого газа с известковой водой). Почему пробирку с малахитом нужно укреплять в лапке штатива наклонно?
Уборка рабочего места: После остывания прибора разберите его. Черный порошок оксида меди сдайте лаборанту. Пробирки сполосните. Стол приведите в порядок.
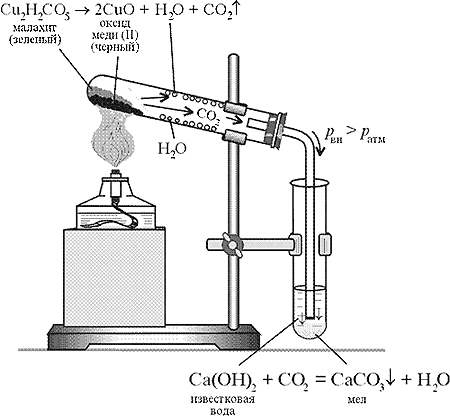
Рис. 1. Разложение малахита
Опыт 2. Очистка загрязненной поваренной соли
Ознакомьтесь с инструкцией к практическому занятию в школьном учебнике. Выполните эксперимент. Продумайте методику организации ПЗ школьников.
Опыт 3. Закон сохранения массы веществ (Сохранение массы веществ при химических реакциях в замкнутом пространстве - модель опыта Ландольта)
Одно колено сосуда Ландольта (Рис. 2) заполните с помощью воронки раствором сульфата меди(II), другое колено - раствором гидроксида натрия. Уберите воронку так, чтобы капли раствора не попали в первое колено. Закройте сосуд пробкой и укрепите на левой дужке весов. Также заполните и второй сосуд Ландольта: одно колено раствором хлорида железа(III), второе - раствором роданида калия. Плотно закройте сосуд пробкой и повесьте на правой дужке весов. Уравновесьте весы.
Осторожно наклоните один из сосудов так, чтобы растворы перемешались. Выпадает осадок. Равновесие весов при этом не нарушается.
Осторожно смешайте растворы во втором сосуде Ландольта. Протекает химическая реакция - образуется кроваво-красный раствор. Равновесие весов сохраняется.
Г. Ландольт проводил подобные опты в течение 16 лет (1892 - 1908) и взвешивал с точностью до 0,00003 г. Этими опытами он подтвердил правильность закона сохранения массы веществ.

Рис. 2. Модель опыта Г.Ландольта
Приложение 1
|
из
5.00
|
Обсуждение в статье: Технологические карты темы и урока химии (Л.И. Асанова) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

