 |
Главная |
Отличительные черты цепных реакций
|
из
5.00
|
- большой квантовый выход;
- высокая чувствительность к примесям;
- зависимость скорости от формы и размеров реакционных сосудов;
Основы количественной теории цепных реакций.
Введем необходимые обозначения:
n  - число центров, возникающих за одну секунду во всем объеме реакционного сосуда;
- число центров, возникающих за одну секунду во всем объеме реакционного сосуда;
τ- время жизни активного центра;
α- вероятность жизни центра;
β- вероятность гибели центра;
t- время, за которое появляется «n» центров;
Очевидно, что, ά + β= 1.
Скорость увеличения числа n определяется уравнением:
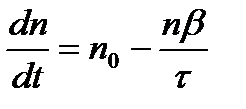
После интегрирования получаем:
n= 

Графическая зависимость n=f(t) представлена на рис.7

Рис.7
При  возникает стационарное состояние, при котором:
возникает стационарное состояние, при котором:
nстац.= n 

При стационарном состоянии число возникающих центров равно числу гибнущих центров. При этом скорость процесса определяется соотношением:
 длинна цепи.
длинна цепи.
В случае разветвленных цепей активный центр, входя в реакцию, воссоздается в виде двух, трех или более новых центров, поэтому необходимо учитывать вероятность разветвления (δ).
Скорость увеличения числа возникающих центров (n) с учетом разветвления цепи, определяется соотношением:

Интегрируя, получаем: n= 
Проанализируем это уравнение для частных случаев.
При β > δ (t→  ) процесс принимает стационарный характер со скоростью:
) процесс принимает стационарный характер со скоростью:
W  =
=  имеет смысл длинны цепи.
имеет смысл длинны цепи.
При δ > β скорость неограниченно увеличивается со временем; изменим знаки:
n= 

Отсюда следует, что при t→  число центров n→
число центров n→  , т.е. с течением времени оно неограниченно увеличиваются по экспоненте и реакция принимает взрывной характер (рис.8).
, т.е. с течением времени оно неограниченно увеличиваются по экспоненте и реакция принимает взрывной характер (рис.8).
 Рис.8
Рис.8
Из рисунка видно, что в начале процесс не развивается. Это индукционный период. Количество продуктов очень мало. Граница перехода стационарного течения реакции к взрыву определяется δ = β.
Величина β может быть изменена условиями реакции, например уменьшением давления.
ГЕТЕРОГЕННЫЕ РЕАКЦИИ
Они протекают в системе, состоящей из нескольких фаз(Г-Т;Г-Ж;Ж-Т)
В этом случае реакция протекает на поверхности двух фаз. Как правило, любая гетерогенная реакция состоит по меньшей мере из трех стадий:
1. Перенос реагирующих веществ к поверхности раздела фаз.
2. Собственно химическая реакция
3. Отвод продуктов реакции из зоны, где эта реакция протекает.
Опыт показывает, что суммарная скорость гетерогенного процесса определяется скоростью наиболее медленной стадией.
Если же скорости отдельных стадий сравнимы между собой, суммарная скорость гетерогенной реакции необязательно должна быть равна скорости самой медленной стадии т. к. все стадии взаимно связаны между собой.
Стадии, протекающие, более быстро могут оказывать влияние и на скорость самой медленной из них.
Скорость гетерогенной реакции прямопропорциональна степени дисперсности реагирующих веществ. Также скорость гетерогенных реакций находится в прямой зависимости от скорости диффузии, т.е. от скорости с которой молекулы газа или растворенного вещества поступают к зоне реакции. Рассмотрим один из простейших случаев, когда скорость реакции на поверхности равна скорости диффузии. Скорость диффузионного потока определяется первым законом Фика:

 количество вещества проходящее через данное сечение, знак минус берется, потому что диффузия проходит против градиента концентрации;
количество вещества проходящее через данное сечение, знак минус берется, потому что диффузия проходит против градиента концентрации;
D- коэффициент диффузии;
 градиент концентрации по оси X.
градиент концентрации по оси X.
Обозначим концентрацию реагирующего вещества через  , тогда скорость реакции на поверхности будет: W=
, тогда скорость реакции на поверхности будет: W=  или -D
или -D 
Заменим выражение:  более простым приближенным β rС:
более простым приближенным β rС:
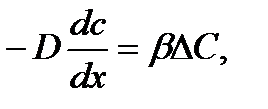 где
где
β- константа скорости диффузии, пропорциональная коэффициенту диффузии, площадь сечения / время.
rС- конечная разность концентраций rС=С- 

Скорость химической реакции протекающей на поверхности и имеющей первый порядок, будет W=  ,где
,где
к- кинетическая константа скорости.
Если скорость диффузии равна скорости химической реакции, то получим: β(С-  )=к
)=к 
Откуда 
Для скорости реакции имеем:

Т.о., мы выразили скорость реакции на поверхности через концентрацию вещества в объеме.
Это выражение справедливо для реакции первого порядка.
Обозначая отношение 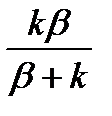 через к* , получим
через к* , получим

k*- связана с истинной константой химической реакции на поверхности и скоростью диффузии соотношением:

Если скорость химической реакции значительно больше скорости диффузии, т.е. k >>β, то  и W=βC.
и W=βC.
Следовательно, общая скорость реакции определяется скоростью диффузии. Можно сказать, что гетерогенная химическая реакция протекает в диффузионной области. Если скорость химической реакции значительно меньше скорости диффузии (к << β), то k* ≈ kи W=кС. Общая скорость реакции вновь определяется скоростью наиболее медленной стадии, т. е. скоростью химической реакции. Это кинетическая область гетерогенной реакции.
Когда к и β сравнимы друг с другом, наблюдается переходная область.
|
из
5.00
|
Обсуждение в статье: Отличительные черты цепных реакций |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

