 |
Главная |
ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ КОНСТАНТЫ СКОРОСТИ РЕАКЦИИ
|
из
5.00
|
Наглядные представления о зависимости скорости химической реакции от температуры дает правило Вант – Гоффа, согласно которому при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза.Это правило первоначально было установлено для реакций, протекающих в растворах при невысоких температурах, и связано с понятием температурного коэффициента скорости реакции γ, определяемого соотношением: 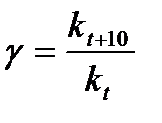
Количественная зависимость константы скорости реакции от температуры была впервые предложена Вант - Гоффом в 1827г., который, основываясь на изменении константы равновесия с температурой, указал, что подобные соотношение должно сохраняться и для константы скорости реакции.
Эта идея была развита Аррениусом, который успешно применил ее к рассмотрению большого числа реакций, поэтому следующее уравнение называют уравнением Аррениуса:
 , где
, где
Еа – аррениусовская, т.е. экспериментальная энергия активации.
А– предэкспоненциальный множитель
Величины Еа и А важнейшие характеристики химической реакции.
Вант – Гофф, используя уравнение, объяснил, почему наблюдающаяся зависимость имеет такой вид.
Напишем уравнение изохоры реакции, которое показывает зависимость константы равновесия от температуры при 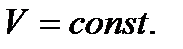
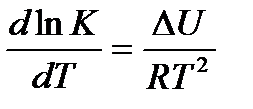 , где
, где
К – константа равновесия:
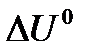 - тепловой эффект реакции при V=const.
- тепловой эффект реакции при V=const.
Как известно для обратимой реакции:
k1
А+В ↔С+D,
k2
идущей в газообразной фазе или в разбавленном растворе константа равновесия равна:
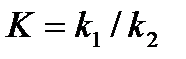
Запишем тепловой эффект как разность: 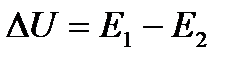 , тогда уравнение изохоры примет вид:
, тогда уравнение изохоры примет вид:
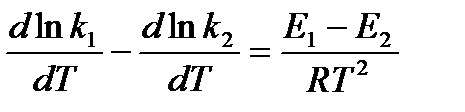
Последнее соотношение можно разбить на два уравнения:
 и
и 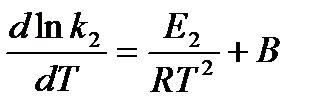 , где
, где
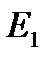 и
и 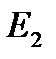 имеют размерность энергии.
имеют размерность энергии.
В - вличина, имеющая одинаковое значение для прямой и обратной реакции, В=О на основании опытных данных.
Тогда для каждой из реакций можно записать:

Так как все взаимодействия идут через стадию образования активных частиц, характеризующихся определенным значением энергии, постоянным для каждой реакции, можно заменить в уравнении Е на величину Еа и перейти к интегральной форме:
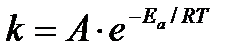
Для объяснения физического смысла величины 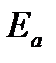 Аррениус предположил, что в реакцию способны вступать не все частицы, а лишь те из них, которые находятся в активированном состоянии.
Аррениус предположил, что в реакцию способны вступать не все частицы, а лишь те из них, которые находятся в активированном состоянии.
Молекулы в активированном состоянии возбуждении за счет избытка энергии и не устойчивы, а в нормальном - стабильны. Между нормальными и активированными молекулами существует равновесие. Доля частиц в возбужденном состоянии относительно мала. Число же частиц в нормальном состоянии практически равно общему числу частиц. Поскольку процесс активации эндотермический, то константа равновесия для этого процесса растет с увеличением температуры. Поэтому возрастает концентрация частиц в активированном состоянии и скорость реакции.
Энергию 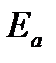 можно определить как тепловой эффект процесса активации.
можно определить как тепловой эффект процесса активации.
|
из
5.00
|
Обсуждение в статье: ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ КОНСТАНТЫ СКОРОСТИ РЕАКЦИИ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

