 |
Главная |
ТЕОРИЯ ПЕРЕХОДНОГО СОСТОЯНИЯ
|
из
5.00
|
Положения теории переходного состояния (ТПС) разработаны Г.Эйрингом и М.Поляни в 30- х годах 20- го столетия.
Они получили выражение для расчета константы скорости и энергии активации простых реакций. Расчеты показали, что при сближении в процессе столкновения частиц А и В возрастает их потенциальная энергия Е  .На некотором расстоянии rа энергия Е
.На некотором расстоянии rа энергия Е 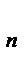 достигает максимума Еmax.
достигает максимума Еmax.
На этом расстоянии происходит реакция и образуются новые частицы С и D, которые затем удаляются и их потенциальная энергия падает (рис.10).
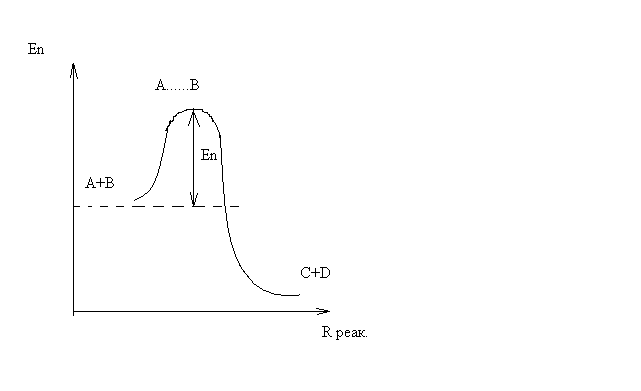
 Рис.10
Рис.10
Зависимость потенциальной энергии Еn от расстояния rреак, определяющего взаимное расположение атомов в реагирующих и образующихся частицах называется кривой потенциальной энергии.
Расстояние 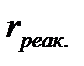 называется координатой реакции.Особенность кривых потенциальной энергии – это наличие максимума. Высота этого максимума равна энергии активации
называется координатой реакции.Особенность кривых потенциальной энергии – это наличие максимума. Высота этого максимума равна энергии активации 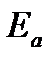 .Исходя из формы кривой потенциальной энергии, величину
.Исходя из формы кривой потенциальной энергии, величину 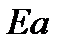 называют часто энергетическим или активационным барьером реакции.
называют часто энергетическим или активационным барьером реакции.
На вершине активационного барьера реагирующие частицы А и В образуют активированный комплекс (А…В), который существует непродолжительное время и быстро распадается, образуя продукты С и D:
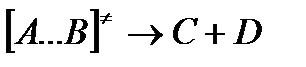
Активированный комплекс находится в равновесии с реагирующими частицами:
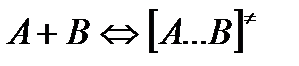
Константа активированного равновесия равна:

Отсюда следует, что концентрация 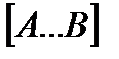 связана с концентрацией реагентов специального образования следующим образом:
связана с концентрацией реагентов специального образования следующим образом:
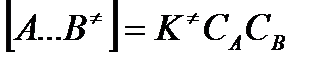
Скорость реакции пропорциональна концентрации этих комплексов, т.к. продукты реакции С и D образуются из этих комплексов:
W= 
k´-коэффициент пропорциональности,  равный RT/ (N
равный RT/ (N  ),где
),где
R- универсальная газовая постоянная;
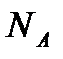 - число Авогадро;
- число Авогадро;
h- постоянная Планка;
Сравнивая полученное выражение с законом действующих масс для скорости реакции W=kCa∙CB, получим выражение для константы скорости.
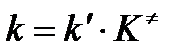
Чтобы получить зависимость теоретической константы скорости от температуры, следует использовать уравнение изотермы реакции Вант – Гоффа
 где
где
 энергия Гиббса активации;
энергия Гиббса активации;
В соответствии с определением  равна:
равна:
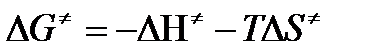 , где
, где
 энтальпия активации;
энтальпия активации;
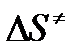 - энтропия активации;
- энтропия активации;
Равенство левых частей позволяет приравнять правые
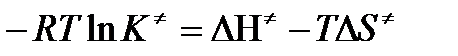
или

или
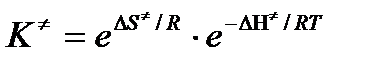
Подставим полученные значения К  в выражение для константы скорости:
в выражение для константы скорости:

Сравнение последнего выражения с уравнением Аррениуса показывает, что предэкспонента равна:
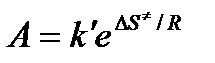 ,
,
а энергия активации: Еа = 
Таким образом, ТПС позволяет связать кинетику химических реакций с термодинамическими характеристиками процесса активации 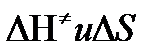 .
.
Из соотношения  следует, что предэкспонента в уравнении Аррениуса определяется изменением энтропии в процессе образования активированного комплекса. Чем больше значение
следует, что предэкспонента в уравнении Аррениуса определяется изменением энтропии в процессе образования активированного комплекса. Чем больше значение 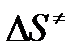 , тем больше А, тем быстрее протекает реакция.
, тем больше А, тем быстрее протекает реакция.
Изменение энергии взаимодействия между атомами, из которых состоят эти частицы, определяются энтальпией активации 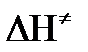
Возрастание этой величины сопровождается таким же возрастанием энергии активации Еа и уменьшением скорости реакции и наоборот.
|
из
5.00
|
Обсуждение в статье: ТЕОРИЯ ПЕРЕХОДНОГО СОСТОЯНИЯ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

