 |
Главная |
Равновесно совершемая работа, равновесно подводимая теплота
|
из
5.00
|
Теплота представляет собой форму передачи энергии которая определяется теплопроводностью, конвекцией и излучением. Количество теплоты является функцией процесса. Подводимая теплота считается положительной, отводимая-отрицательной. dq = Cdt
Равновесное состояние – это когда в любой сколь угодно малой части рабочего тела все параметры постоянны и имеют одинаковое значение. Любые реальные процессы это не равновесные процессы. Для совершенно равновесного процесса необходимо бесконечно большой промежуток времени. Процесс называется стационарным если термодинамические параметры не изменяются с течением времени. На практике большинство процессов можно считать равновесными. Необходимым и достаточным условием равновесия является постоянство каких-либо двух параметров. Равновесные процессы удобно изображать графически, где состояние измеряется точкой, а процесс сплошной линией.
Билет
Степени свободы молекул. Закон распределения энергии теплового движения по степеням свободы. Внутренняя энергия идеального газа. Теплоемкость. Удельная, молярная теплоемкость вещества.
Степени свободы молекул
Наименьшее число независимых координат, определяющих положение и конфигурацию молекулы в пространстве, называется числом степеней свободы молекулы
| Y |
| X |
| 0 |
| Z |
| Y |
| X |
| 0 |
| Z |
| Y |
| X |
| 0 |
| Z |
| в |
Модели молекул : а – одноатомной, б – двухатомной, в – трехатомной
Число степеней свободы для одноатомной молекулы – 3 (поступательное движение в направлении трех координатных осей), для двухатомной – 5 (три поступательных и две вращательных), для трехатомной – 6 (три поступательных и три вращательных).
Закон распределения энергии теплового движения по степеням свободы
Закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная  kT, а на каждую колебательную степень свободы – в среднем энергия, равная kT.
kT, а на каждую колебательную степень свободы – в среднем энергия, равная kT.
Средняя энергия молекулы
˂ε˃ =  k T,
k T,
Где i – сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы.
Внутренняя энергия идеального газа
Внутренняя энергия –Энергия хаотического (теплового) движения микрочастиц системы и энергии взаимодействия этих частиц
U =  RT = ν
RT = ν  RT,
RT,
Где M – молярная масса; ν =  – количество вещества.
– количество вещества.
Теплоемкость
Теплоемкость тела – физическая величина, определяемая отношением бесконечно малого количества теплоты  , полученного теплом, к соответствующему приращению его температуры
, полученного теплом, к соответствующему приращению его температуры  :
:
C = 
Удельная теплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
c = 
Единицей удельной теплоемкости является джоуль на килограмм-кельвин [Дж/(кг · К)].
Молярная теплоемкость – величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
 =
=  ,
,
где ν =  – количество вещества.
– количество вещества.
Единица молярной теплоемкости – джоуль на моль-кельвин [Дж/(моль · К)].
Билет № 23
Политропный процесс-Процесс, в котором теплоемкость остается постоянной, называется политропным. Исходя из первого начала термодинамики при условии постоянства теплоемкости (С= const), можно вывести уравнение политропы: 
Где  показатель политропы.
показатель политропы.
Политропа в координатах р, V— гипербола, занимающая промежуточное положение между изотермой и адиабатой.
График:

Частные случаи Политропного процесса:
| 1)Изохорный процесс | 2)Изотермический процесс | 3)Изобарный процесс | 4)Адиабатический процесс |

| 
| 
| 
|
Билет №24
ИЗОХОРНЫЙ ПРОЦЕСС (  )
)
Изохорный процесс в идеальном газе описывается законом Шарля:
при постоянном объеме давление данной массы газа прямо пропорционально его термодинамической температуре:
 или
или  .
.

Работа газа при изохорном процессе равна нулю:  .
.
Все полученное тепло идет на изменение внутренней энергии в соответствии с первым началом термодинамики:
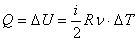 .
.
Первое начало термодинамики для этого процесса
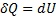
Вся теплота сообщаемая газу идет на увеличение ее внутренней энергии
Билет № 25
ИЗОБАРНЫЙ ПРОЦЕСС ( 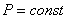 )
)
Для изобарного процесса в идеальном газе справедлив закон Гей-Люссака:
при постоянном давлении объем данной массы газа прямо пропорционален его термодинамической температуре:
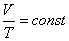 или
или  .
.

Работа газа при изобарном расширении:
 .
.
Изменение внутренней энергии:

Количество полученного тепла в соответствии с первым началом термодинамики:
 .
.
Первое начало термодинамики для этого процесса

Количество теплоты сообщаемое газу расходуется на изменение его внутренней энергии и на совершение работы против внешних сил
Билет № 26
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС (  )
)
Изотермический процесс в идеальном газе подчиняется закону Бойля - Мариотта:
для данной массы газа при неизменной температуре произведение значений давления и объема есть величина постоянная:
 или
или  .
.
Работа газа при изотермическом расширении:

Первый закон термодинамики для процесса
т.е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:  Следовательно, для того чтобы при расширении газа температура не понижалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения
Следовательно, для того чтобы при расширении газа температура не понижалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения
График:

Билет№ 27
Адиабатным называется процесс при котором отсутствует теплообмен между системой и окружающей средой
( Q = 0). К адиабатным процессам можно отнести все быстропротекающие процессы. Адиабатным процессом, например, можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не
успевает. Адиабатные процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т.д. Из первого начала термодинамики  для адиабатного процесса следует, что
для адиабатного процесса следует, что 
Работа над внешними силами совершается за счет убыли внутренней энергии
Продифференцировав уравнение состояния для идеального газа р V
Исключим температуру Т:
Разделив переменные и учитывая что  найдем
найдем
Интегрируя это уравнение в пределах от р1 ДО р2 и соответственно от V1 до V2, а затем потенцируя, придем к выражению
Так как состояния 1 и 2 выбраны произвольно, то можно записать
Полученное выражение есть уравнение адиабатного процесса, называемое также уравнением Пуассона.
График:
Билет № 28
Энтропия — в естественных науках мера неупорядоченности системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния.
 где
где  — приращение энтропии;
— приращение энтропии;  — минимальная теплота, подведённая системе;
— минимальная теплота, подведённая системе;  — абсолютная температура процесса.
— абсолютная температура процесса.
Энтропия при изохорном процессе:
 , т.к.
, т.к.  ;
;
|
из
5.00
|
Обсуждение в статье: Равновесно совершемая работа, равновесно подводимая теплота |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

