 |
Главная |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ. Оборудование:штативы, пробирки, спиртовки, держатели, набор реактивов в капельницах и
|
из
5.00
|
Оборудование:штативы, пробирки, спиртовки, держатели, набор реактивов в капельницах и бюксах.
Опыт 1. Получение оксидов
а) Термическое разложение дихромата аммония.
В сухую пробирку внесите два – три шпателя дихромата аммония, осторожно нагрейте на спиртовке. Запишите уравнение реакции, назовите полученные вещества.
б) Термическое разложение гидроксида меди.
В сухую пробирку внесите 3-4 капли сульфата меди, добавьте несколько капель гидроксида калия. Полученный осадок нагревайте на спиртовке до изменения цвета. Напишите уравнения реакций, назовите полученные вещества.
Опыт 2. Получение оснований
а) Взаимодействие оксидов с водой.
Внесите в пробирку один шпатель оксида кальция и добавьте воды. Добавьте в пробирку 1-2 капли фенолфталеина. Объясните появление окраски, напишите уравнение реакции, назовите полученные вещества.
б) Взаимодействие солей со щелочами.
Внесите в первую пробирку 5-6 капель соли кобальта, добавьте 2-3 капли гидроксида калия. Напишите уравнение реакции, отметьте цвет осадка, назовите полученные вещества.
Внесите во вторую пробирку 5-6капель соли никеля, добавьте 2-3 капли гидроксида калия. Напишите уравнение реакции, отметьте цвет осадка, назовите полученные вещества.
Опыт 3. Получение кислот
Внесите в первую пробирку порошок карбоната натрия, добавьте 1 пипетку раствора серной кислоты. Напишите уравнение реакции, назовите полученные вещества.
Внесите во вторую пробирку 1 мл силиката натрия. Добавьте при непрерывном перемешивании 1 пипетку раствора серной кислоты. Напишите уравнение реакции, назовите полученные вещества.
Опыт 4. Получение солей
а) Реакция нейтрализации.
Внесите в пробирку 3-4 капли гидроксида калия и 1-2 капли фенолфталеина. Прибавляйте по каплям соляную кислоту до исчезновения окраски. Напишите уравнение реакции, назовите полученные вещества.
б) Взаимодействие основного оксида с кислотой. Внесите в пробирку один шпатель оксида меди и несколько капель серной кислоты. Осторожно нагрейте пробирку. Напишите уравнение реакции, назовите полученные вещества.
Лабораторная работа № 2
ПРИГОТОВЛЕНИЕ РАСТВОРОВ
Цель работы: научиться готовить растворы, рассчитывать необходимое количество реагентов, пересчитывать одну концентрацию в другую, контролировать концентрацию приготовленного раствора по его плотности, определяя плотность раствора ареометром.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Основные понятия химии
Атом - мельчайшая химически неделимая частица вещества.
Молекула – наименьшая частица вещества, обладающая всеми химическими свойствами данного вещества.
Относительная масса элемента – это отношение массы его атома к 1/12 массы атома изотопа углерода 12C. Единица измерения относительной массы называется атомная единица массы (а.е.м.).
1 а.е.м. 1,66∙10-24 г
1,66∙10-24 г
Величины атомных масс элементов в а.е.м приводятся  в периодической системе Д.И.Менделеева. Атомные и молекулярные массы, выраженные в а.е.м, являются относительными (обозначаются Ar и Mr, соответственно), они показывают, во сколько раз масса одного атома элемента или молекулы вещества больше массы 1/12 части массы атома изотопа углерода 12С.
в периодической системе Д.И.Менделеева. Атомные и молекулярные массы, выраженные в а.е.м, являются относительными (обозначаются Ar и Mr, соответственно), они показывают, во сколько раз масса одного атома элемента или молекулы вещества больше массы 1/12 части массы атома изотопа углерода 12С.
Относительную молекулярную массу (Mr) вещества высчитывают в а. е.м., округляя значения массы до целых, при этом у хлора Cl – до десятых (35,5 а. е.м.).
Mr (H2O) = 1∙2 + 16 = 18 (а.е.м.),
Mr (H3PO4) = 1∙3 + 31 + 16∙4 = 98 (а.е.м.).
Моль (n) – это количество вещества, содержащее столько же структурных единиц (атомов, молекул, ионов), сколько атомов содержится в 12 г атома изотопа углерода 12C.
Молярная масса (M) – это масса 1 моля вещества. Молярная масса M численно равна относительной молекулярной массе Mr:
Mr (H2O) = 18 а.е.м.
M (H2O) = 18 г/моль.
В 1 моле содержится число Авогадро частиц
NА = 6,022∙1023 моль-1
В количественных расчетах в химии также широко используется понятие «химический эквивалент».
Химический эквивалент вещества - условная или реальная частица этого вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалента (равноценна) одному иону водорода в ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Это величина безразмерная. Состав эквивалента, как и состав атомов, молекул, ионов выражают с помощью химических знаков и формул.
Примеры определения формулы эквивалента:
а) KOH + HCl = KCl + H2O
OH− + H+ = H2O
С одним ионом водорода H+ реагирует один ион гидроксогруппы OH−, поэтому эквивалентом гидроксогруппы является сама гидроксогруппа – реальная частица.
б) Са (ОН)2 + 2НСI = CaCI2 + 2H2O
Са (ОН)2 + 2H+ + 2CI− = Ca2+ + 2CI− + 2H2O
По уравнению реакции видно, что на 2 иона H+ приходится 1 ион Ca2+, тогда на 1 ион H+ (эталон эквивалента) будет приходиться ½ иона Ca2+, т. е эквивалентом иона Ca2+ является ½ Ca2+ - условная частица.
Э (Са2+) = 1/2 Са2+.
Рассуждая аналогично, можно составить пропорции и по другим частицам. Так, на 2 иона H+ приходится 2 иона CI− , 2 иона OH− , поэтому
Э (СI−) = CI− (реальная частица), Э (ОН−) = ОН− (реальная частица).
Молярная масса эквивалента (МЭ) – это масса 1 моля эквивалентов вещества.

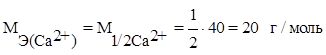
а) молярная масса эквивалента основания
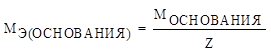
где Z – число функциональных групп, т.е. число гидроксогрупп OH−в молекуле основания.
б) молярная масса эквивалента кислоты

где Z – число функциональных групп, т.е. число атомов водорода в молекуле кислоты.
в) молярная масса эквивалента соли

Основные законы химии
|
из
5.00
|
Обсуждение в статье: ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ. Оборудование:штативы, пробирки, спиртовки, держатели, набор реактивов в капельницах и |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

