 |
Главная |
Лабораторная работа № 3. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
|
из
5.00
|
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Цель работы: на основании экспериментальных данных выявить зависимость скорости химической реакции от концентрации
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Закон действия масс
Различные химические реакции протекают с различными скоростями: быстро – выпадение осадка в реакциях ионного обмена; мгновенно – взаимодействие водорода и кислорода, происходит взрывообразно; медленно – коррозия металлов, которая протекает годами.
Под скоростью химической реакции понимают изменение концентрации реагирующих веществ с течением времени:

В уравнении знак «+» показывает, что с течением времени концентрация продуктов реакции увеличивается, знак «–», что с течением времени концентрация исходных веществ становится меньше. Время, как правило, выражается в секундах.

Рис. 3.1 Зависимость концентрации веществ от времени протекания реакции, а – исходные вещества; б – продукты реакции.
Для изучения кинетики химических реакций, большое значение имеет не только определение скорости реакции, но и определение механизма протекания реакции.
Уравнения химических реакций указывают только начальное и конечное состояние системы и являются символическим выражением материального баланса (закона сохранения массы веществ). В действительности реакция может протекать через ряд промежуточных стадий, так называемых элементарных актов реакции. Например, реакция окисления иодоводорода пероксидом водорода записывается следующим образом:
2HI + H2O2 ® I2 + 2H2O
Механизм этой реакции представлен следующими стадиями:
1) HI + H2O2 ® HIO + H2O (медленная стадия)
2) HIO + HI ® I2 + H2O (быстрая стадия)
Скорость и общий порядок реакции определяется медленной стадией -лимитирующая стадия реакции. Такие реакции называются сложными.
К сложным реакциям также относятся цепные реакции (простые и разветвленные), например, реакция образования хлороводорода из простых веществ, которая на свету сопровождается взрывом:
H2 + Cl2  2HCl
2HCl
Для цепных реакций характерны 3 стадии:
1) стадия зарождения цепи
Cl2  2Cl·
2Cl·
2) стадия развития цепи
H2 + Cl· ® HCl + H· 
H· + Cl2 ® HCl +Cl· и т.д.
3) стадия обрыва цепи
H· + H· ® H2
Cl· + Cl·→ Cl2
Cl· + H·→ HCl
Cl· + стенка → Cl
К сложным относятся и параллельные реакции:
 4KCl + 6O2
4KCl + 6O2
 4KClO3
4KClO3
3KClO4 + KCl

Рис. 3.2 Зависимость концентрации продуктов реакции от времени протекания реакции.1 – обычная реакция; 2 – цепная реакция; I – первая стадия; II – вторая стадия; 3 – III – третья стадия.
Число молекул, участвующих в одном элементарном акте реакции, называется молекулярностью реакции. Одностадийная реакция, в которой участвует только одна молекула, называется мономолекулярной. Реакция, в которой участвуют две молекулы – бимолекулярная, реакции в которых участвуют три молекулы – тримолекулярная (так как вероятность одновременного столкновения трех разных молекул мала, то и тримолекулярные реакции очень редки).
Факторами, влияющими на скорость реакции, являются природа и концентрация реагирующих веществ, температура, давление (для газовой фазы), а для гетерогенной реакции еще и площадь соприкосновения.
Зависимость скорости реакции от концентрации выражается законом действия масс (ЗДМ), сформулированным в 1867 г. Гульдбергом и Вааге:
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степень, равную коэффициентам в уравнении реакции.
Так, для гомогенной реакции
aA + bB = cC + dD
можно записать:

где СA, CB – текущие концентрации исходных веществ A и B;
a, b – коэффициенты в уравнении химической реакции;
k – константа скорости реакции,она равна скорости реакции при концентрациях веществ равных единице.
Константа скорости не зависит от концентрации реагирующих веществ, а определяется только природой реагирующих веществ и условиями протекания процесса.
Если эта реакция протекает в газовой фазе, то закон действия масс записывается следующим образом:
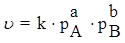
где pA, pB – текущие парциальные давления компонентов A и B.
Порядок реакции – это показатель степени, в которой входит концентрация этого вещества в уравнение скорости реакции. Но, как правило, порядок реакции и стехиометрические коэффициенты совпадает лишь для некоторых простых реакций. Для сложных реакций порядок реакции определяется экспериментально. Порядок реакции - величина формальная. Он может быть положительным, отрицательным, дробным, нулевым - это свидетельствует о многоступенчатом характере протекающей реакции.
|
из
5.00
|
Обсуждение в статье: Лабораторная работа № 3. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

