 |
Главная |
Физические типы кристаллических решеток
|
из
5.00
|
В зависимости от природы частиц, находящихся в узлах кристаллической решетки, и от характера сил взаимодействия между частицами различают четыре основных типа кристаллических решеток и, соответственно, четыре типа кристаллов, а именно, ионные, атомные, металлические и молекулярные.
Ионные кристаллы
В узлах кристаллической решетки помещаются ионы разных знаков. Силы взаимодействия между ними являются в основном электростатическими (кулоновскими). Связь, обусловленная электростатическими силами притяжения между разноименно заряженными ионами, называется гетерополярной (или ионной). Типичным примером ионной решетки может служить решетка каменной соли NaСl, которая принадлежит к кубической системе (см. рис. 4).

Рис. 4. Кубическая решетка соли NaCl.
Белые кружки – положительные ионы натрия, черные кружки - отрицательные ионы хлора.
Как видно из рисунка, ближайшими соседями иона данного знака будут ионы противоположного знака. Ионный кристалл состоит не из молекул NaCl, а из ионов. Иногда весь такой кристалл в целом рассматривают как одну гигантскую молекулу.
Ионная связь возникает обычно между атомами, одни из которых (как правило, атом металла) способны легко отдавать, а другие (например, галогены) – легко принимать электроны. Энергия такой связи U0 значительна и в кристалле она даже превышает таковую для соответствующей уединенной молекулы. Так, для упомянутой молекулы NaCl энергия U0 = 5,5 эВ, а в кристалле она соответствует U0 = 8,9 эВ, что связано с увеличенным количеством ионов, соседствующим с ионом противоположного знака.
Вследствие больших значений U0 твердые тела с таким видом связи высокопрочны и тугоплавки, причем это не только соединения металлов с галогенами (NaCl, KCl, CsJ, RbBr и т.д.), но и сульфиды, неорганические окислы и ряд других материалов.
Атомные кристаллы
В узлах кристаллической решетки помещаются нейтральные атомы. Связь, объединяющая в данном случае атомы, называется гомеополярной (или ковалентной).
В ковалентную связь чаще всего вступают однородные атомы. Очевидно, что в этом случае невозможно создание ионной связи. Однако валентные электроны обоих атомов могут переходить от одного атома к другому, образуя таким образом новое состояние – систему атомов с локально обобществленными электронами. Если валентные электроны атомов имеют противоположно направленные спины, то квантово-механический расчет показывает увеличение модуля волновой функции электронов в области пониженной потенциальной энергии между атомами. Следовательно, каждая пара электронов находится преимущественно между ядрами соседних атомов, притягивая их к себе, а значит, и друг к другу.
Гомеополярная (ковалентная) связь может осуществляться только валентными, т.е. наименее связанными с атомом электронами. Поскольку каждый электрон может обеспечить связь только с одним атомом, то число связей, в которых может участвовать данный атом, равно его валентности.
Следует отметить, что ковалентная связь реализуется не только в твердых телах, но и в газах при образовании двухатомных молекул из однородных атомов, например, H2, O2, N2 и т.п.
Энергия ковалентной связи U0 обычно составляет несколько электронвольт. Поэтому твердые тела с ковалентной связью оказываются прочными, имея к тому же высокую температуру плавления (алмаз, кварц, кремний).
Поскольку одни и те же атомы могут, в принципе, образовывать различные пространственные комбинации ковалентных связей (т.н. полиморфизм), то соответствующие твердые тела могут существенно различаться по своим свойствам.
Типичными примерами подобных атомных кристаллов могут служить алмаз и графит. Оба эти вещества тождественны по химической природе, поскольку построены только из атомов углерода, но различаются кристаллическим строением. На рис. 5 показана слева решетка алмаза, а справа – решетка графита.
Разница в механических свойствах алмаза и графита общеизвестна. Причину этого наглядно демонстрирует особенности их кристаллического строения. В частности, у графита плоскости решетки легко перемещаются и отрываются друг от друга. Эта же разница в кристаллическом строении определяет и их различные электрические свойства – графит довольно хорошо проводит электрический ток, а алмаз – полупроводник, причем с очень слабой даже для полупроводников собственной проводимостью.
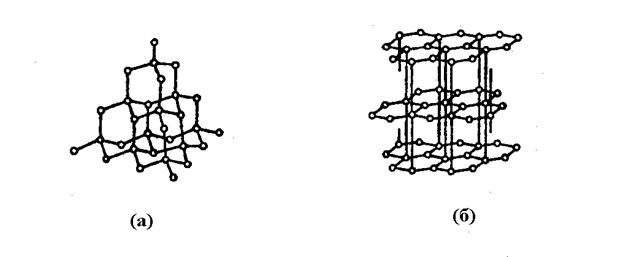
Рис. 5. Атомные кристаллы – алмаз (слева), графит (справа)
Интересно отметить, что в последние два десятилетия обнаружены новые виды углерордных кристаллов, а именно, фуллерены (ячейка в форме баскетбольного мяча), нанотрубки и графен (т.е., соответственно, сферический, трубатый и плоский кристалл одноатомной толщины), свойства которых, а также возможные области применения сейчас очень широко изучаются.
В заключение этого раздела необходимо указать, что широко используемые в электронной технике кремний Si и германий Ge, являющиеся типичными полупроводниками, имеют решетку типа алмаза.
|
из
5.00
|
Обсуждение в статье: Физические типы кристаллических решеток |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

