 |
Главная |
Химико-технологического процесса
|
из
5.00
|
Учебное пособие
по курсу «Общая химическая технология»
Материальный баланс
химико-технологического процесса
Предлагаемая читателю книга является учебным пособием по курсу общей химической технологии. Содержание книги соответствует разделу программы «Анализ ХТС» и включает теоретическую часть с примерами и собственно задачи по составлению материальных балансов и расчету технологических показателей эффективности функционирования химико – технологических систем (ХТС).
Теоретическая часть представлена тремя разделами. Первый содержит сведения о структуре ХТС и способах её представления, второй посвящен методике расчета составов материальных потоков на входе и выходе из подсистемы химического превращения, третий и основной раздел включает информацию о материальных балансах ХТС и методике их составления.
Вторая часть пособия является собственно задачником и содержит более ста задач по составлению материальных балансов простых, сложных и обратимых процессов.
Книга предназначена для студентов, обучающихся по дисциплине «Общая химическая технология» для специальностей технологического и механического профиля. Указанное пособие может быть также использовано преподавателями ВУЗов для пополнения банков собственных задач.
1.Химико-технологическая система
Прежде чем приступить к расчетам в области проектирования химико-технологических процессов, следует познакомиться с такими понятиями, как система, структура системы и способы её представления.
Системойназывают упорядоченную совокупность объединенных какими-либо связями материальных объектов, предназначенную для достижения определенной цели по возможности наилучшим способом.
По субстанциональному признаку различают три класса систем: естественные, искусственные и концептуальные.
Химико-технологическая система (ХТС) относится к числу искусственных. Эта система предназначена для выпуска химических продуктов высокого качества с минимальными затратами ресурсов и минимальным воздействием на окружающую среду.
Каждая система обладает структурой. Под структурой понимают совокупность элементов и связей между ними, обладающую инвариантностью (неизменностью) на определённом отрезке времени
Элементом системы является материальный объект, выполняющий определенные функции в рамках системы и не подлежащий дальнейшему членению. В качестве элементов ХТС выступают операторы и подсистемы.
Операторами называют химические и физические процессы, с помощью которых осуществляется последовательное превращение сырья в продукт. К ним относятся массообменные, тепловые, механические, гидромеханические и химические процессы.
Подсистемой называют обладающую относительной автономией в рамках ХТС совокупность операторов, объединенных единой технологической целью. Её конкретное оформление соответствует производственной установке. Цель зафиксирована в наименовании подсистемы. К основным подсистемам ХТС относят подсистему подготовки сырья, химического превращения, выделения целевого продукта из реакционной смеси, обработки технического продукта.
Операторы объединяются в систему с помощью связей. Связь – это физический канал, по которому происходит обмен веществом, энергией и информацией между элементами системы (внутренняя связь) и между отдельными системами (внешняя связь). На рис.1 показаны внешние связи системы.

Рис.1 Внешние связи ХТС
По физическому смыслу связи подразделяют на материальные, энергетические и информационные. Первые два типа связей относят к технологическим. Материальные связи представляют собой потоки сырья, вспомогательных материалов, полупродуктов, продуктов, твердых, жидких и газообразных отходов.
К энергетическим относят потоки топлива, хладоагентов и теплоносителей, линии электропередачи. С инженерной точки зрения технологические связи в ХТС представлены в виде магистралей, трубопроводов, газо- и водопроводов, топливопроводов, электрокабелей, и т.п.
Прежде чем приступить к технологическим расчетам следует четко представлять систему и её структуру, поскольку в основе материального баланса лежит знание абсолютного состава потоков сырья, вспомогательных материалов, полупродуктов, продуктов и т.д., поступающих в аппарат (на установку) и покидающих его.
Химико-технологические системы обладают сложной структурой, которая содержит множество операторов и многочисленные комбинации разнообразных связей между ними. В ходе разработки ХТС из набора альтернативных структур стараются получить оптимальную систему с минимальным, но необходимым набором операторов и связей, достаточных для её нормального функционирования.
Существует несколько форм представления структур: вербальное, графическое (топологическое) и описание в виде матрицы.
Вербальное (словесное) описание используют при документальном оформлении технологической схемы, которая является одним из разделов технологического регламента.
Графические методы наиболее наглядны и информативны.
В зависимости от элементного состава, характера связей и предназначения различают функциональные, операторные, структурные и технологические схемы. Все эти схемы являются этапами синтеза и анализа ХТС.
Элементами структуры функциональной схемы выступают подсистемы, соединенные материальными связями.
Элементами операторной схемы служат технологические операторы, так же объединенные в систему материальными связями. Эти схемы дают наглядное представление о физико-химической сущности технологических процессов, используемых системой для последовательного превращения сырья в готовый продукт. Схема может быть так же использована для составления материального баланса, при условии исключения из неё тех операторов, в которых не происходит изменение состава.
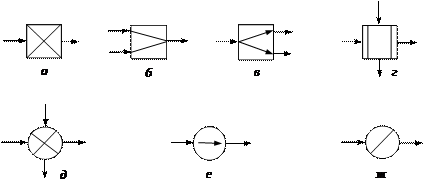 На рис. 2 показаны графические символы основных операторов и функции, которые они выполняют.
На рис. 2 показаны графические символы основных операторов и функции, которые они выполняют.
Рис. 2 Технологические операторы:
основные: а – химического превращения, б – смешения,
в – разделения, г – межфазного массообмена;
вспомогательные: д– нагрева или охлаждения, е – сжатия или расширения, ж – изменения агрегатного состояния вещества
Структурная схема составляется на основе операторной. В этой схеме операторы представлены в виде блоков, соединенных между собой горизонтальными линиями материальных связей. Вертикальные линии изображают энергетические связи. Такие схемы используют при проектировании теплового регулирования процесса, то есть для выбора теплоносителей или хладоагентов для обеспечения заданного температурного режима работы каждого аппарата. На основе этой схемы составляются тепловые балансы процессов.
Технологическая схема составляется на основе операторной, при этом каждый оператор заменяется конкретным аппаратом, который наиболее соответствует требованиям той технологической операции, для которой предназначен аппарат (реактор, смеситель, теплообменник и т.д.).
Представленные в этом пособии задачи содержат упрощенные описания предлагаемых для расчета баланса процессов. Научитесь переводить словесное описание на язык графики. В операторе над материальным потоком совершается какое-либо действие. Действие в описании обычно выражают глаголом или отглагольными существительными и прилагательными.
 Если в описании сказано «смешивают», значит два (или больше) потока надо подать в смеситель:
Если в описании сказано «смешивают», значит два (или больше) потока надо подать в смеситель:
 Если сказано «смешанный», значит, поток выходит из смесителя, в котором смешалось минимум два потока:
Если сказано «смешанный», значит, поток выходит из смесителя, в котором смешалось минимум два потока:
 Если сказано «пары нагревают», значит, жидкость надо сначала испарить, а затем нагреть пары:
Если сказано «пары нагревают», значит, жидкость надо сначала испарить, а затем нагреть пары:
Наш опыт показывает, что, несмотря на кажущуюся простоту и очевидность вышеизложенного, перевод словесного описания в графику вызывает у студентов затруднения.
В качестве примера составления разнообразных схем, приведем структуру системы, производящей изопентан из н-пентана.
Описание процесса. Смесь свежего и возвратного н-пентанов поступает в колонну азеотропной осушки и отпарки углеводородов выше С5, смешивается с водородом, затем нагревается в рекуперационных теплообменниках за счет теплоты газообразной реакционной смеси и её конденсата. Дополнительный нагрев до температуры реакции происходит в трубчатой печи за счет радиации пламени. Горячая исходная смесь реагентов поступает в реактор, где на твердом катализаторе протекает реакция изомеризации.
н-С5Н12 ® изо-С5Н12
Водород в систему добавляют для подавления побочных реакций. Реакционная смесь после охлаждения в рекуперационных теплообменниках поступает в конденсатор, затем в сепаратор, в котором происходит разделение фаз. Водород, отделившийся от конденсата, проходит через адсорбер, где освобождается от фтористых соединений, попавших в поток реакционной смеси с катализатора, затем в сепараторе окончательно освобождается от остатков конденсата. Далее в компрессоре его смешивают со свежим водородом, сжимают и снова подают в процесс.
Конденсат, содержащий изопентан, непревращенный пентан и побочные продукты через буферную емкость и теплообменники поступает на ректификацию, где выделяются целевой изопентан, побочные продукты и непревращенный н-пентан, который возвращается в процесс. Изопентан после очистки от F – соединений поступает на склад готовой продукции.
1.1 Функциональная схема.
Составляем список операторов, в порядке их появления от входа сырья в систему и заканчивая выводом готового продукта.
1. Смешение свежего и возвратного н-пентанов.
2. Азеотропная осушка и отпаривание примесей углеводородов выше С5.
3. Смешение пентана с водородом.
4. Нагрев смеси в рекуперационных теплообменниках и в печи.
5. Химическое превращение
6. Охлаждение реакционной смеси в рекуперационных теплообменниках
7. Конденсация паров жидких продуктов реакции и непревращенного сырья.
8. Сепарация (разделение жидкой и газовой фаз).
9. Адсорбция из потока водорода F- соединений.
10. Сепарация (окончательная).
11. Смешение свежего и возвратного водорода и компримирование.
12. Ректификация конденсата.
13. Адсорбция F – соединений из изопентана.
Операторы объединим в подсистемы, учитывая цели, которые достигаются в операторе или группе операторов в процессе синтеза изопентана. Из приведенного списка видно, что эти операции укладываются в три подсистемы:
- подсистема подготовки сырья (операторы 1-4)
- подсистема химического превращения (оператор 5)
- подсистема выделения целевого продукта (операторы 6-13)
Поскольку полученному продукту необходимо придать товарный вид, добавим подсистему обработки технического продукта. Так же в состав системы следует ввести подсистему экологизации.
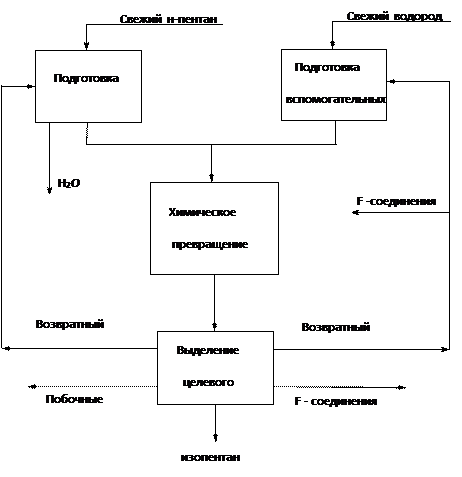 Соединим подсистемы линиями материальных потоков и получим функциональную схему производства изопентана.
Соединим подсистемы линиями материальных потоков и получим функциональную схему производства изопентана.
Рис.3. Функциональная схема производства изопентана.
1.2. Операторная схема
В соответствии с перечнем операторов и описанием процесса, составляем схему.
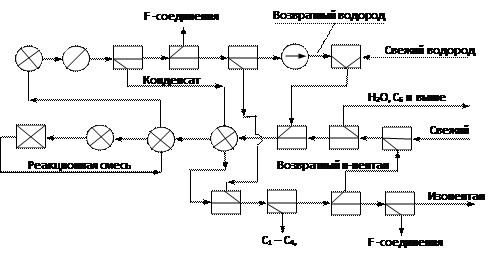 |
Рис. 4 Операторная схема производства изопентана.
1.3. Структурная схема
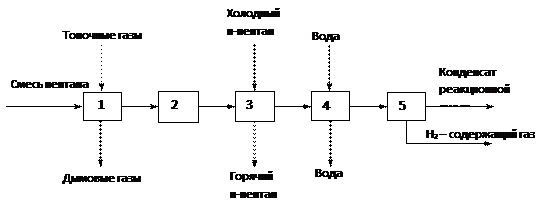 В качестве примера составим структурную схему реакторного блока изомеризации н-пентана.
В качестве примера составим структурную схему реакторного блока изомеризации н-пентана.
Рис. 5 Структурная схема реакторного блока изомеризации н-пентана
1 – печь; 2 – реактор; 3 – рекуперативный теплообменник; 4 – конденсатор; 5 - сепаратор
2. Состав исходных и реакционных смесей
Состав является важнейшим параметром технологического режима, оказывающим влияние на скорость химической реакции и сопровождающих её физических процессов, качество продукта, безопасность ведения процесса и т.д.
Изменение состава происходит в операторах смешения, разделения и химического превращения. В первых двух состав изменяется за счет физических процессов смешения исходных веществ или разделения смесей на отдельные компоненты или фракции. В операторе химического превращения состав изменяется за счет протекания химической реакции, когда количество исходных веществ уменьшается, а продуктов – увеличивается.
Условимся поток реагентов на ходе в реактор (в оператор «химическое превращение») называть исходной смесью, а реакционной смесью – выходящий и реактора поток.
 |
2.1 Расчет состава исходной смеси
Различают качественный и количественный составы. Качественный состав включает перечень компонентов, содержащихся в потоке. Например, природный газ содержит метан СН4 и его гомологи: этан С2Н6, пропан С3Н8, а так же примеси СО2 и H2S.
Качественный состав является исходным для расчета количественного состава.
Количественный состав характеризуется точными значениями количеств отдельных компонентов смеси и может быть выражен в абсолютных единицах (кг., м3, кмоль) и относительных (%%, долях) единицах. Мерой относительного состава является концентрация (содержание).
В технических расчетах состав выражают в массовых, мольных и объёмных единицах.
Расчет состава проводят в следующей последовательности:
 |
Рис.6 Логическая структура расчета состава смеси
2.1.1 Расчет массового состава смеси
Единицей измерения массового состава в системе СИ является массовая доля, выраженная в процентах. Технологи для упрощения предпочитают говорить «массовый процент». В нашей книге мы будем пользоваться последним обозначением (%мас).
Если имеется смесь, в составе которой имеется GА кг вещества А и GВ кг вещества В, то содержание отдельных компонентов можно вычислить, приняв общую массу смеси за 100%. Тогда концентрации А и В составят: 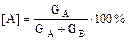 мас,
мас,  мас.
мас.
Если массу смеси принять за единицу, тот концентрации А и В составят, соответственно:
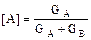 мас. долей
мас. долей  мас. долей
мас. долей
Выполняя расчеты, проще пользоваться массовыми долями. При расчете многокомпонентных смесей, концентрацию последнего компонента, чтобы исключить (скомпенсировать) неизбежную ошибку округления, вычисляют по разности 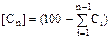 %мас. Аналогично для массовых долей, только сумму долей от первого до предпоследнего компонентов вычитают из единицы:
%мас. Аналогично для массовых долей, только сумму долей от первого до предпоследнего компонентов вычитают из единицы: 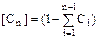 мас долей.
мас долей.
2.1.2. Расчет молярного состава смеси
Если имеется смесь, содержащая МА киломолей вещества А и МВ киломолей вещества В, то содержание отдельных компонентов можно вычислить, приняв сумму киломолей за 100%. Тогда концентрации А и В составят: 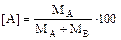 % мол,
% мол,  % мол.
% мол.
Если сумму киломолей принять за единицу, получим концентрации в мольных долях:
 мол. долей
мол. долей 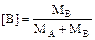 мол. долей
мол. долей
2.1.3. Расчет объёмного состава смеси
Если имеется смесь, содержащая VА м3 вещества А и VВ м3 вещества В, то и состав можно вычислить как в объёмных процентах (%об), так и в объёмных долях:
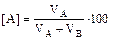 % об,
% об, 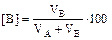 % об.
% об.
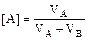 об. долей
об. долей 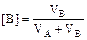 об. долей
об. долей
Следует отметить, что для газовых смесей мольный и объёмный составы совпадают. Это следует из того, что один киломоль любого газа при нормальных условиях занимает объём 22,4 м3 ( закон Авогадро).
ВНИМАНИЕ! За 100% всегда принимают общее количество смеси (массу, объём или число киломолей).
В некоторых расчетах используют мольно-объёмную (кмоль/м3) или массово-объёмную (г/л) концентрацию
2.1.4. Пересчет составов смесей из одной системы единиц в другую
Достаточно часто в технологических расчетах приходится иметь дело с потоками реагентов, состав которых задан в различных единицах, например, один поток в %мас, а другой – в % моль. Чтобы не совершить непоправимую ошибку при смешении этих потоков, следует составы привести к одним единицам. На нескольких примерах покажем алгоритм пересчета. Расчеты удобнее вести в табличной форме.
Пример1
Таблица 1 Пересчет объёмного состава смеси в массовый (вариант 1)
| Исходные данные | Расчет массового состава | ||||
| Компонент | % об | м3 | кмоль | кг | % мас |
| О2 | 21,1 | 21,1 | 21,1/22,4=0,942 | 0,942×32=30,04 | 30,08×100/124,41=24,25 |
| N2 | 69,8 | 69,8 | 69,8/22,4=3,116 | 3,116×28=87,25 | 87,25×100/124,41=70,19 |
| NH3 | 9,1 | 9,1 | 9,1/22,4=0,406 | 0,406×17=6,90 | 6,9×100/124,41=5,56 |
| Итого | 100 | 100 | 4,464 | 124,41 | 100 |
Во втором столбце таблицы указан объёмный состав смеси. В данном примере мы задались общим объёмом смеси 100 м3. Можно задаться любым объёмом, в том числе использовать конкретное значение существующего газового потока. Зная состав и общий объём, легко вычислить объёмы каждого компонента, затем, используя закон Авогадро, переходим к киломолям, и, умножая на молекулярную массу, - к массам отдельных компонентов.
Напомним, что для газовых смесей %об = % моль. Чтобы убедиться в этом, найдем мольный состав смеси. Сумму киломолей (0,942+3,116+0,406) принимаем за 100%. Вычислим содержание компонентов: [О2]=0,942×100/4,464=21,1% моль и т.д. Теперь, если задаться количеством смеси 100 кмоль, расчет упрощается.
Пример 2.
Таблица 2 Пересчет объёмного состава смеси в массовый (вариант 2)
| Исходные данные | Расчет массового состава | ||||
| Компонент | % об | % моль | кмоль | кг | % мас |
| О2 | 21,1 | 21,1 | 21,1 | 21,1×32=675,2 | 675,2×100/2784,3=24,25 |
| N2 | 69,8 | 69,8 | 69,8 | 69,8×28=1954,4 | 1954,4×100/2784,3=70,19 |
| NH3 | 9,1 | 9,1 | 9,1 | 9,1×17=154,7 | 154,7×100/2784,3=5,56 |
| Итого | 100 | 100 | 100 | 2784,3 | 100 |
Пример3.
Таблица 3 Пересчет массового состава смеси в объёмный
| Исходные данные | Расчет массового состава | ||||
| Компонент | % мас | кг | кмоль | м3 | % об |
| SО2 | 50 | 50 | 50/64=0,781 | 0,781×22,4=17,494 | 17,494×100/57,478=30,43 |
| N2 | 50 | 50 | 50/28=1,785 | 1,785×22,4=39,984 | 39,984×100/57,478=69,57 |
| Итого | 100 | 100 | 2,566 | 57,478 | 100 |
Здесь мы задались общей массой смеси 100 кг. Далее, используя те же законы, как и в предыдущих примерах, определяем массы, кмоли, объёмы и, наконец, % об отдельных компонентов. В этом примере можно сразу определить мольные %%, которые равны объёмным.
Примечания:
1. Как видим, получилась большая разница между массовыми и объёмными единицами, в то время как в первых двух примерах различие не столь велико. Так происходит, если велика разница молекулярных масс компонентов.
2. Из последнего примера видно, насколько серьезно следует относиться к расчетам: если не заметить, что даны не массовые проценты, а объёмные, то вы смешаете компоненты в неприемлемом, иногда взрывоопасном соотношении.
2.1.5 Формирование состава исходной смеси
Состав смеси на входе в оператор может быть задан в форме рецептуры или соотношения.
Рецептура может быть представлена массовым, объёмным или мольным составами.
Пример 4.
Приготовить 3 т. смеси по следующей рецептуре, % мас:
Изобутен 17,6
Изопрен 0,6
Хлористый метил 81,8
Найти загрузку каждого компонента
Решение
1. Загрузка изобутена 3×0,176=0,528 т
2. Загрузка изопрена 3×0,006=0,018 т
3. Загрузка хлористого метила 3-(0,528+0,018)=2,32 т
(массу последнего компонента лучше вычислять по разности).
Пример 5.
Приготовить смесь заданной в первом примере рецептуры, если в наличии имеется 0,5 т изобутена
Решение
1. Определяем количество смеси (100%), которое можно приготовить из 0,5 т изобутена, если известно его содержание в этой смеси (17,6%).
17,6% - 0,5 т, т
100% - к-во смеси 0,5/0,176=2,84 т.
2. Загрузка изопрена 2,84×0,006=0,017 т
3. Загрузка хлористого метила 2,84-(0,5+0,017)=2,32 т.
ВНИМАНИЕ! В химической технологии понятия сырьё и реагент не всегда совпадают. Реагент – это полезный компонент сырья, который в результате химической реакции превращается в нужный нам (целевой) продукт. Остальные компоненты сырья являются примесями к реагенту. Технологические расчеты ведут сначала по реагенту, затем вычисляют загрузку сырья.
Например, по расчету в процесс следует ввести 980 кг серной кислоты, а у нас имеется только разбавленная водой (примесь) 70 %-ная Н2SO4. Определить, сколько следует взять разбавленной кислоты, чтобы загрузить нужное количество (980 кг) реагента можно из пропорции:
980 кг Н2 SO 4 составляет в разбавленной к-те 70%
тогда вся к-та - 100%
Отсюда количество разбавленной кислоты 980×100/70=1400 кг.
Пример 6
Рассчитать объёмный состав потока, полученного смешением технического аммиака и воздуха.
Объёмная скорость подачи технического аммиака 1000 м3/час
воздуха 2000 м3/час
Состав, %об: технического аммиака NH3 – 95,0 ; CH4 – 5,0
воздуха О2 – 21,0 ; N2 – 79,0
Решение.
 1. Составим схему материальных потоков смесителя с указанием их направления и оценим их. Ценой потока называют сведения о потоке: количество, состав, параметры состояния и др.
1. Составим схему материальных потоков смесителя с указанием их направления и оценим их. Ценой потока называют сведения о потоке: количество, состав, параметры состояния и др.
2. Определяем качественный состав выходящего из смесителя потока, который, конечно же, будет содержать все компоненты входящих потоков.
3. Находим состав смеси сначала в абсолютных единицах (м3/час), затем в относительных (%об).
Таблица 4 Расчет объемного состава смеси
| Компонент | м3/час | %об |
| NH3 | 1000×0,95=950 | 950×100/3000=31,7 |
| CH4 | 1000×0,05=50 | 50×100/3000=1,6 |
| О2 | 2000×0,21=420 | 420×100/3000=14,0 |
| N2 | 2000×0,79=1580 | 1580×100/3000=52,7 |
| Итого | 3000,0 | 100,0 |
Часто состав исходной смеси реагентов удобнее задать в виде массового, объёмного, мольного и стехиометрического соотношений компонентов. Форма записи состава в этом случае следующая:
а) H2 : N2 = 1 : 2 (мас). Запись читается «водород и азот подают в массовом соотношении один к двум». То есть, на каждый килограмм водорода в смеси содержится 2 кг азота.
б) H2 : N2 = 1 : 2 (моль). Запись читается «водород и азот подают в мольном соотношении один к двум». То есть, на каждый киломоль водорода в смеси содержится 2 киломоля азота.
в) H2 : N2 = 1 : 2 (об). Запись читается «водород и азот подают в объёмном соотношении один к двум». То есть, на каждый кубометр водорода в смеси содержится 2 м3 азота.
г) Стехиометрическое соотношение это мольное соотношение, численно равное коэффициентам в стехиометрическом уравнении химической реакции. Например, синтез аммиака протекает по уравнению N2 + 3H2 ®2NH3.
Коэффициенты уравнения при реагентах – 1 и 3. Взять реагенты в стехиометрическом соотношении – значит загрузить их в соотношении N2 : H2 = 1 : 3 (моль).
Не следует путать мольные и массовые соотношения, поскольку при одинаковом их численном выражении (1 : 2), массовые загрузки будут совершенно различны. Так, для H2 : N2 = 1 : 2 (мас) на каждый килограмм водорода следует подать 2 кг азота. Содержание компонентов в смеси H2 =1×100/(1+2)=33,3 %мас; N2=2×100/(1+2)=66,7 %мас.
Для H2 : N2 = 1 : 2 (моль) на каждый киломоль водорода (2 кг) нужно взять 2 кмоль (56 кг) азота. Содержание компонентов в смеси H2 =2×100/(2+56)=3,33 %мас; N2=2×100/58=96,67 %мас.
Если общее количество смеси и соотношение выражены в одних единицах, расчет проблем не вызывает.
Пример 7.
Приготовить 60 кг смеси в массовом соотношении NH3 : O2 = 1 : 2.
Решение.
1. Смесь состоит из 1+2=3 частей (одна часть – аммиак, две части – кислород).
2. На каждую часть приходится 60/3=20 кг
3. Тогда в соответствии с заданным соотношением нужно взять
NH3=1×20=20 кг, O2=2×20=40 кг.
Этот пример легко решить «в уме». Проще всего, когда задано соотношение 1 : 1. Тогда и без расчета ясно, что компонентов нужно взять «поровну». Однако состав может быть многокомпонентный, а соотношение – нецелочисленное, например, 1,3 : 2,75 : 0,21. Поэтому всегда нужно следовать алгоритму, показанному выше.
Если общее количество смеси и соотношение выражены в разных единицах, расчет усложняется.
Пример 8.
Приготовить 640 кг смеси газов в мольном соотношении SO2 : O2 = 1:1.
Решение
1. Сначала вычислим массовый состав смеси, если её приготовить в заданном мольном соотношении:
Искусственная смесь Концентрации компонентов
1 кмоль SO2 – 64 кг SO2 =64×100/(64+32)=66,7 % мас
1 кмоль O2 –32 кг O2 =32×100/(64+32)=33,3 % мас
2. Точно такая же концентрация компонентов должна соблюдаться и в 640 кг смеси, которую надо приготовить. Тогда компонентов следует взять:
SO2 =640×0,663=428,8 кг O2 =640×0,333=211,2 кг.
Этот алгоритм применяется во всех случаях, когда не совпадают размерности соотношения и общего количества. Легко заметить, что так можно вычислять загрузку, если задано не соотношение, а процентный состав, т.к. мольное соотношение 1 : 1 в данном примере соответствует составу SO2=50 % моль, O2 =50 %моль.
В следующем примере показана методика расчета, если жестко не задано общее количество смеси.
Пример 9.
В реакторе протекает реакция C2H4 + HCN ® C2H5CN
Реагенты подают в мольном соотношении C2H4 : HCN = 2 : 1
Состав потоков:
 этан – этиленовая фракция, % мас циановодород, % мол
этан – этиленовая фракция, % мас циановодород, % мол
Этилен 60 HCN 90
Этан 40 Н2 10
Вычислить абсолютный состав исходной смеси реагентов.
Поскольку задано мольное соотношение, удобнее выполнить расчет, исходя из 100 киломолей технического HCN, тем более, что состав этого потока выражен в мольных процентах. Затем по соотношению получим число киломолей этилена и вычислим массы всех остальных компонентов. Расчет выполним в виде таблицы:
Таблица 5. Расчет абсолютного состава смеси
| Компонент | % моль | % мас | кмоль | кг |
| HCN | 90 | - | 90 | 90×27=2430 |
| Н2 | 10 | - | 10 | 10×2=20 |
| C2H4 | - | 60 | 2×90=180 | 180×28=5040 |
| С2Н6 | - | 40 | 3360/30=112 | 5040×40/60=3360 |
| Итого | 100 | 100 | 392 | 10850 |
Здесь массу этана вычислили из пропорции
Масса C 2 H 4 (5040 кг) составляет в потоке 60%мас
Масса С2Н6 (Х)----------------------------------40 % мас С2Н6=5040×40/60=3360 кг
До сих пор мы имели дело с газовыми смесями, для которых %моль = % об. Для жидкостей подобное равенство не соблюдается, так что для вычисления объёмов и объёмных концентраций нужно использовать плотность (r, кг/м3) смешиваемых жидкостей.
Пример 10.
Рассчитать массовый, мольный и объёмный составы смеси бензола (мол. масса 78, r=879 кг/м3) и толуола (мол. масса 92, r= 867 кг/м3), взятых в мольном соотношении, равном 1 : 1. Ход расчета понятен из таблицы.
Таблица 6. Расчет состава жидких смесей
| Исходные данные | Состав смеси | |||||
| Компонент | кмоль | % мол | кг | % мас | м3 | % об |
| Толуол | 1 | 50 | 1×92=92 | 92×100/170=54,1 | 92/867=0,106 | 0,106×100/0,195=54,36 |
| Бензол | 1 | 50 | 1×78=78 | 78×100/170=45,9 | 78/879=0,089 | 0,089×100/0,195=45,64 |
| Итого | 2 | 100 | 170 | 100 | 0,195 | 100 |
В предыдущих примерах мы показали несколько вариантов расчета состава смесей, когда не совпадают размерности соотношения и общего количества. Всего сочетаний задания количества смеси и её состава может быть 12. Все они представлены ниже в виде контрольных заданий, в которых требуется вычислить массы компонентов в смеси.
Таблица 7. Контрольные задания
| № п/п | Количество смеси | Состав смеси |
| 1 | 200 кг | СО – 10 % мас; Н2 – 90 % мас |
| 2 | 300 кг | SO2 : О2 = 1 : 2 (мас) |
| 3 | 500 кг | NH3 : О2 = 1 : 3 (моль) |
| 4 | 600 кг | H2S – 10 % моль; О2 – 90 % моль |
| 5 | 500 кмоль | СО – 30 % мас; Н2 – 70 % (мас) |
| 6 | 800 кмоль | SO2 : О2 = 1 : 2 мас |
| 7 | 300 кмоль | NH3 : О2 = 1 : 4 (моль) |
| 8 | 400 кмоль | H2S – 20 % моль; О2 – 80 % моль |
| Окончание табл.7 | ||
| 9 | 2000 м3 | СО – 20 % мас; Н2 – 80 % мас |
| 10 | 500 м3 | SO2 : О2 = 1 : 3 (мас) |
| 11 | 1000 м3 | NH3 : О2 = 1 : 2 (моль) |
| 12 | 3000 м3 | H2S – 40 % моль; О2 – 60 % моль |
2.1.6 Разбавление концентрированных потоков
В производственных условиях часто образуются материальные потоки с низким содержанием полезного компонента. С другой стороны, в целом ряде технологий применение высококонцентрированного сырья может вызвать осмоление, высаливание и множество других отрицательных явлений, снижающих показатели качества и эффективности основного процесса. Для разбавления высококонцентрированного сырья до заданного значения можно воспользоваться инертным растворителем или низкоконцентрированным потоком, содержащим нужный компонент и не имеющим вредных примесей.
Пример 11.
Из 40 %-ного раствора NаОН получить 10 т разбавленного до 10 % раствора.
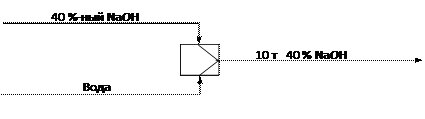 1. Составим схему материальных потоков смесителя
1. Составим схему материальных потоков смесителя
2. Находим абсолютный состав потока смеси:
NaOH 10×0,1=1,0 т вода 10-1=9 т.
3. Поскольку NaOH (1 т) поступает только с 40 %-ным потоком, то масса этого потока составит 1/0,4=2,5 т, в том числе воды 2,5-1=1,5 т.
4. Из баланса по воде находим количество воды на разбавление 9-1,5=7,5 т.
Пример 12.
Приготовить 8 т 40 %-ной серной кислоты из 98 %-ной и 10 %-ной H2SO4.
1. Составим схему материальных потоков смесителя
 |
2. Принимаем количество поступающей 98 %-ной H2SO4 за Х т., тогда масса 10 %-ной H2SO4 составит (8-Х) т.
3. Находим количество H2SO4, которое содержится в 8 т 40 %-ной кислоты:
8×0,4=3,2 т
4. Составим уравнение материального баланса:
0,98Х+0,1(8-Х)=3,2 отсюда Х=2,727 т.
Таким образом, 98 %-ной кислоты следует взять 2,727 т, а массу разбавленной найдем по разности: 8-2,727=5,273 т.
Пример 13.
Расчет показал, что на проведение процесса потребуется ввести 42 киломоля кислорода. Поток окислителя получают, смешивая воздух с техническим кислородом. Концентрация кислорода в смеси должна составить 30 % об.
Состав, % об:
 Технический кислород Воздух
Технический кислород Воздух
Кислород 96 21
Азот 4 79
Определить массу, объём и число кмолей смешиваемых потоков.
1. Составим схему материальных потоков смесителя
 |
2. По количеству кислорода находим общее количество смеси:
42 кмоль составляют 30%
Вся смесь - 100% масса смеси 42/0,3=140 кмоль
3. Введём обозначения:
количество поступающего воздуха Х кмоль
количество технического кислорода 140-Х
В воздухе содержится 0,21×Х киломолей кислорода, а в тех. кислороде 0,96(140-Х) киломолей.
Всего в смеси должно быть 42 киломолей О2. Составляем баланс по кислороду:
0,21Х+0,96(140-Х)=42 отсюда Х=123,2 кмоль
Прочие расчеты сведём в таблицу 8:
Таблица 8. Расчет разбавления газовых потоков
| Потоки | кмоль | м3 | кг |
| Воздух | 123,2 | 123,2×22,4=2759,68 | О2 :123,2×0,21×32=827,904 N2 :123,2×0,79×28=2725,184 Всего воздуха 3553,088 |
| Тех. кислород | 140-123,2=16,8 | 16,8×22,4=376,32 | О2 : 16,8×0,96×32=516,096 N2 : 16,8×0,04×28=18,816 Всего тех. кислорода 534,912 |
| Итого 4088,0 |
Пример 14.
Для получения ацетатного прядильного раствора ацетилцеллюлозу растворяют в смеси ацетона и воды. Рассчитать загрузку воды и ацетона, исходя из следующих условий.
Загрузка сухой ацетилцеллюлозы, кг 100
Остаточная влажность ацетилцеллюлозы, % мас 0,8
Влажность ацетона, % мас 0,4
Содержание ацетилцеллюлозы в
прядильном растворе, % мас 25,0
Содержание во
|
из
5.00
|
Обсуждение в статье: Химико-технологического процесса |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

