 |
Главная |
Задача столь же легко решается, если в условиях задана производительность установки по продукту
|
из
5.00
|
Пример 26.
1. Составить материальный баланс производства бензойной кислоты путём окисления толуола воздухом.
2. Рассчитать технологические показатели.
Исходные данные:
Производительность установки по бензойной кислоте, тыс.т/год 90,0
Число рабочих дней в году 340,0
Состав безводной реакционной смеси, % мас.
Бензойная кислота 20,0
Бензальдегид 5,0
Толуол 75,0
Потери толуола, % от теоретического расхода 5,0
Избыток воздуха сверх теоретического, % 50,0
В реакторе протекают следующие реакции:

Краткое описание процесса:
Толуол, нагретый до 800С, подают в реактор-колонну, работающую под давлением. Туда же через барботёр, расположенный в днище колонны, подают воздух. В толуоле предварительно растворяют катализатор – нафтенат кобальта. Температура процесса 1300С, давление 20 ат. Реакционную массу выгружают, охлаждают, и при этом бензойная кислота кристаллизуется и выпадает в осадок, а раствор бензальдегида в толуоле возвращают на окисление.
Расчёт баланса
Составляем схему материальных потоков установки в соответствии с исходной информацией:

Видно, что на входе имеются два потока известного состава, но неизвестной массы. Из сепараторов выходят потоки абгаза и реакционной массы, причём известны только состав одного из потоков и масса бензойной кислоты. Следовательно, для составления материального баланса необходимо рассчитать массы всех потоков баланса на входе и выходе.
ВНИМАНИЕ! При расчёте материального баланса консекутивной реакции, в которой целевым является конечный продукт, следует помнить, что количество промежуточного продукта (в данном случае бензальдегида), полученного в первой реакции, складывается из продукта, израсходованного на вторую реакцию, т.е. превращённого в конечный продукт (бензойную кислоту), и непревращённого продукта, обнаруженного в реакционной массе.
Далее производим следующие расчёты:
1. Рассчитываем часовую производительность реактора по бензойной кислоте, кмоль×ч-1:
 кг/ч или
кг/ч или  кмоль/час
кмоль/час
2. Определяем количество реакционной массы, исходя из количества бензойной кислоты и её содержания в реакционной массе, кг/час:
11029,41кг/ч бензойной к-ты составляет – 20 %
Тогда вся реакционная масса (Х) — 100 % Х=11029,4/0,2=55147,05 кг/час
3.Находим количество бензальдегида, содержащегося в реакционной массе, (5 %),:
 кг/час или
кг/час или  кмоль/час
кмоль/час
4. Определяем количество толуола в реакционной массе по разности:
 кг/час
кг/час
5. Напоминаем, что расчёт количества образовавшегося в реакции 1 промежуточного продукта начинают с конца, т.е. с конечной реакции. Поскольку известно количество бензойной кислоты, полученной во второй реакции, можно на основе стехиометрии этой реакции найти затраченный на получение кислоты бензальдегид: 90,405 кмоль/час
6. Зная, что в реакционной массе содержится 26,01275 кмоль×ч-1 бензальдегида, находим его количество, полученное по реакции 1:  кмоль×/час
кмоль×/час
7. Рассчитываем расход толуола на реакцию 1:
С учётом стехиометрии этой реакции толуола расходуется столько же, сколько получается бензальдегида, т.е. кмоль на кмоль:
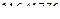 кмоль/час или
кмоль/час или  кг/час
кг/час
8. Определяем расход толуола с учётом потерь:  кг/ч,
кг/ч,
в том числе потери составят 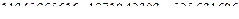 кг/×час
кг/×час
9. Находим количество толуола, поступающего в реактор. Это количество слагается из толуола, найденного в реакционной массе (непревращённый толуол), толуола, израсходованного в первой реакции, и потерь:  кг/час
кг/час
10. Рассчитываем количество подаваемого в реактор воздуха. Для этого находим расход кислорода на обе реакции, учитываем избыток, а затем пересчитываем найденное количество кислорода на воздух, т.е. определяем:
- расход О2 на реакцию 1, кмоль/час: 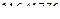 ;
;
- расход О2 на реакцию 2, кмоль/час:  (0,5 кмоль на моль толуола в соответствии со стехиометрией);
(0,5 кмоль на моль толуола в соответствии со стехиометрией);
- суммарный расход О2 на реакции 1 и 2, кмоль/×час: 
- расход О2 с учётом избытка в 50 %:
 кмоль/час или
кмоль/час или  кг/час, в том числе избыток О2:
кг/час, в том числе избыток О2:  кмоль/час или
кмоль/час или  кг/час
кг/час
Известно, что избыток не реагирует, поэтому указанное количество кислорода войдёт в состав абгаза как непревращённый кислород.
11. Рассчитываем количество подаваемого в реактор окисления воздуха (кг/ч). Поскольку массовый состав воздуха известен (О2 = 23 %мас), количество воздуха найдём из соотношения:
7757,77248 кг/ч О2 составляют 23 %
Тогда воздух (Х) – 100 % Х=7757,77248/0,23=33729,445 кг/час
в том числе азот:  кг/час.
кг/час.
12. Определяем количество воды, образовавшейся по реакции 1:
 кг/×час-
кг/×час-
13. Составляем таблицу материального баланса:
Таблица 20. Материальный баланс производства бензойной кислоты
| Приход | Расход | ||||
| № | Компоненты | кг/час | № | Компоненты | кг/час |
| 1. | Толуол | 52606,243116 | 1. | Реакционная масса, в том числе: Бензойная кислота Бензальдегид Толуол | 55147,05 11029,41 2757,3525 41360,2875 |
| 2. | Воздух, в том числе Кислород Азот | 33729,44556 7757,77248 25971,67308 | 2. | Абгаз, в том числе: Кислород Азот | 28557,59724 2585,92416 25971,67308 |
| 3. | Вода | 2095,51968 | |||
| 6. | Потери толуола | 535,521696 | |||
| Итого: | 86335,6887 | Итого: | 86335,6887 | ||
14. Рассчитываем технологические показатели:
- общая конверсия толуола 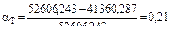 ;
;
Для определения доли толуола, превращённого в бензойную кислоту, используем соотношение из стехиометрии реакции:
122 кг бензойной к-ты образуется из 92 кг толуола
А 11029 кг из — Х кг Х=11029×92/122=8317
- избирательная конверсия (селективность) по толуолу 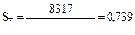
- выход бензойной кислоты по толуолу:  %
%
Для расчёта этого показателя определяем теоретический выход кислоты, исходя из поданного в процесс толуола, из соотношения:
Из 92 кг толуола образуется 122 кг бензойной к-ты
Из 52606 кг должно получиться – G Т GТ=52606×122/92=69760
- выход бензойной кислоты на превращённый толуол:

Для расчёта этого показателя определяем теоретический выход кислоты, исходя из превращённого толуола:
92 кг — 122 кг
(52606 – 41360) — 
 =(52606-41360)×122/92=14913
=(52606-41360)×122/92=14913
- теоретические расходные коэффициенты:
по толуолу 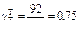 т/т,
т/т,
по воздуху  т/т;
т/т;
- фактические расходные коэффициенты:
по толуолу  т/т,
т/т,
по воздуху  т/т.
т/т.
Смешанные реакции
В смешанных последовательно – параллельных реакциях
A + B  Rц (1)
Rц (1)
R + B  S (2)
S (2)
реагент В расходуется параллельно в обеих реакциях, реагент А – только в первой, образуя последовательность А š R š S, а промежуточный продукт R частично превращается в S по реакции 2 (GR2). Материальный баланс такого процесса может быть представлен в виде:
 ,
,
здесь  = GR1 – GR2.
= GR1 – GR2.
В зависимости от комбинации исходных данных возможны несколько вариантов расчета недостающих для баланса величин.
Так, если известны фактически полученный S (  ) и количество превращенного В, то алгоритм расчета включает следующую последовательность операций:
) и количество превращенного В, то алгоритм расчета включает следующую последовательность операций:
- определение расхода В (GВ2) на вторую стадию (реакция 2) по величине фактически полученного продукта S.
- определение расхода R (GR2) на вторую стадию (реакция 2) по стехиометрии
- определение расхода В (GВ1) на первую стадию (реакция 1) по разности
GB1=GВпр-GB2-GBp, где GВпр – количество превращенного В, GBp – потери В.
- определение расхода А (GА1) по стехиометрии реакции 1, исходя из количества GВ1
- определение фактически полученного R (  ) на стадии 1 по расходу GВ1 или GА1.
) на стадии 1 по расходу GВ1 или GА1.
Если известны выходы bR и bS по реагенту А и конверсия последнего - aА, применяем следующий алгоритм:
- задаемся количеством поданного в процесс реагента А (GА)
- находим массу вступившего в реакцию реагента А (aА×GА) и непревращенного 
- по величине bS находим фактически полученный продукт S (  )
)
- по величине (  ) и стехиометрии второй стадии определяем расходы R (GR2) и В (GB2) на вторую стадию реакции
) и стехиометрии второй стадии определяем расходы R (GR2) и В (GB2) на вторую стадию реакции
- по величине bR находим фактически полученный продукт R (  )
)
- расход реагента В на первой стадии можно определить через стехиометрию этой стадии и превращенное количество реагента А (aА×GА) или обратным ходом, через общее количество образовавшегося в реакции 16 продукта R (  + GR2 )
+ GR2 )
3.6.3 Обратимые реакции
К обратимым относятся реакции, которые протекают в прямом и обратном направлениях с образованием одного (простая обратимая) или нескольких (сложная обратимая) рядов продуктов.
Если в необратимых реакциях величина максимальной конверсии определяется только временем пребывания потока в реакторе (временем реакции), то в обратимых реакциях максимальная степень превращения сырья ограничена состоянием равновесия, которое устанавливается в реагирующей системе при достижении равенства скоростей прямой и обратной реакций. Положение равновесия (равновесная конверсия) зависит от условий проведения процесса (температуры, давления, состава потока питания реактора). При их изменении равновесие смещается в сторону большей или меньшей конверсии в соответствии с принципом Ле-Шателье. Поэтому для расчёта материального баланса обратимой реакции, кроме законов сохранения массы и стехиометрических соотношений, используют выражение для константы равновесия, которое связывает между собой значение константы равновесия КР с равновесным составом реакционной смеси. Для газофазной реакции :

уравнение для константы равновесия запишется в виде
 (3.20),
(3.20),
где КР – константа равновесия, РА, РВ, РR, PS – парциальные давления реагентов и продуктов в реакционной смеси к моменту равновесия. Взамен парциальных давлений в уравнении можно использовать также значения концентраций или активностей компонентов системы.
По закону Дальтона парциальное давление i-го компонента равно
 , (3.21)
, (3.21)
где Р – общее давление смеси, ат; mi – количество кмолей i-го компонента; n – число компонентов в системе;  - общее число кмолей компонентов системы. Уравнение для расчета константы равновесия берут из справочной литературы или составляют на основе уравнения стехиометрии реакции. Поскольку константа равновесия зависит от температуры, при расчёте КР следует воспользоваться уравнением для температурной зависимости константы, которое можно найти в справочниках термодинамических величин.
- общее число кмолей компонентов системы. Уравнение для расчета константы равновесия берут из справочной литературы или составляют на основе уравнения стехиометрии реакции. Поскольку константа равновесия зависит от температуры, при расчёте КР следует воспользоваться уравнением для температурной зависимости константы, которое можно найти в справочниках термодинамических величин.
Обращаем ваше внимание на то, что часто в справочниках выражение для константы равновесия приводят не в «классическом» виде (ур-ние 3.20). Независимо от вида стехиометрического уравнения в числитель заносят концентрации (парциальные давления) тех реагентов, которые взаимодействуют с выделением тепла (экзоэффект), а в знаменатель – с поглощением тепла. Так, для обратимой реакции синтеза аммиака N2 + 3H2 D 2NH3 +46100 кДж/моль
вместо  записывают
записывают 
Расчеты с использованием обеих формул приводят к одинаковым результатам, однако при поиске в литературе, например, зависимости Кр от температуры, следует точно установить, для какой системы записи приведено данное выражение.
Расчёт материального баланса обратимой реакции начинают с определения равновесного состава реакционной смеси при заданных условиях синтеза. Решив его относительно равновесного содержания целевого продукта или любого компонента реакционной смеси, задаются степенью приближения к равновесию и находят фактический состав на выходе из реактора.
Решение задачи по определению состава равновесной смеси сводится к определению мольных долей компонентов смеси, так как общее давление в системе обычно известно.
Мольные доли компонентов в равновесной смеси чаще всего связывают с числом молей Х исходного вещества, прореагировавшего к моменту равновесия. Так для реакции:

положим, что количество молей реагентов А и В в исходной смеси  . Тогда в равновесной смеси
. Тогда в равновесной смеси  . Суммарное число молей в системе
. Суммарное число молей в системе

Парциальные давления каждого компонента в системе:

После подстановки выражений Рi в выражение для Кр, получим квадратное уравнение:

Корень этого уравнения удовлетворяющий условиям  дает количества прореагировавших к моменту равновесия реагентов А и В. В зависимости от стехиометрии реакции могут получатся уравнения дробных или третьей и выше степеней. Решать такие уравнения можно методами последовательных приближений или с помощью математических пакетов для РС. В состав исходной смеси можно включать любые (в том числе и заданные в условиях) количества исходных реагентов. Иногда удобнее считать сначала на 1 киломоль реагента с последующим пересчетом на реальную подачу.
дает количества прореагировавших к моменту равновесия реагентов А и В. В зависимости от стехиометрии реакции могут получатся уравнения дробных или третьей и выше степеней. Решать такие уравнения можно методами последовательных приближений или с помощью математических пакетов для РС. В состав исходной смеси можно включать любые (в том числе и заданные в условиях) количества исходных реагентов. Иногда удобнее считать сначала на 1 киломоль реагента с последующим пересчетом на реальную подачу.
Если стехиометрические коэффициенты в уравнении реакции равны единице, определение мольных долей компонентов не вызывает затруднений. В более сложных случаях учитывают стехиометрию. Например, в реакции: 2А⇌В к моменту равновесия прореагировало 2Х молей реагента А  , однако образовалось Х молей продукта В
, однако образовалось Х молей продукта В  .
.
В реакции: А⇌2В прореагировало Х молей реагента А, образовалось же 2Х молей продукта.
Необязательно за неизвестное Х принимать только прореагировавшие количества реагентов. Имеется три варианта математического описания равновесной смеси:
1. За неизвестные (х или у) принимают количества реагентов А и В прореагировавших к моменту установления равновесия;
2. За неизвестное (х или у) принимают количество в равновесной смеси ключевого компонента, чаще всего промежуточного продукта;
3. За неизвестное (х или у) можно принять равновесную конверсию реагента (Выраженную в долях от единицы).
Результаты вычислений во всех случаях одинаковы, однако математические выражения для констант равновесия в некоторых вариантах получаются проще. Например, для сложной обратимой реакции: А + В D D (K1)
D DC (K2)
Мольные доли компонентов в равновесной смеси можно выразить тремя способами.
Таблица 21. Варианты расчета равновесной смеси.
| Компонент | Исходная смесь, кмоль | Равновесная смесь, кмоль | ||
| Вариант 1 | Вариант 2 | Вариант 3 | ||
| А | 
| 
| 
| 
|
| В | 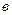
| 
| 
| 
|
| D | 
| 
| 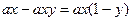
| |
| С | у | 
| 
| |

| 
| 
| 
| |
В варианте 1 за  приняты количества реагентов А и В, за
приняты количества реагентов А и В, за  - количество промежуточного продукта D, прореагировавших к моменту равновесия. Поэтому количество D в равновесной смеси определяется разностью
- количество промежуточного продукта D, прореагировавших к моменту равновесия. Поэтому количество D в равновесной смеси определяется разностью  (образовалось, минус израсходовалось).
(образовалось, минус израсходовалось).
Во втором варианте выражения для остаточных количеств исходных реагентов А и В получены из следующих соображений: реагент расходуется на промежуточный продукт (  моль), из которого, в свою очередь, образуется конечный продукт (
моль), из которого, в свою очередь, образуется конечный продукт (  моль). Следовательно, в равновесной смеси осталось
моль). Следовательно, в равновесной смеси осталось  моль реагента А.
моль реагента А.
В третьем варианте  -равновесная конверсия реагента А,
-равновесная конверсия реагента А,  -промежуточного продукта D.
-промежуточного продукта D.
Выражения для констант равновесия приведены ниже.
Вариант 1 
Вариант 2 
Вариант 3 
Как видим, во втором варианте получаются несколько более простые математические выражения. Несмотря на очевидную сложность третьего варианта, несомненное его достоинство в том, что напрямую вычисляется равновесная конверсия реагентов.
В данном пособии все примеры с обратимыми реакциями рассчитаны по первому варианту. Пользоваться или нет другими способами – оставляем на усмотрение читателей.
3.6.3.1 Простая обратимая реакция
Пример 27.
Расчёт материального баланса процесса с простой обратимой реакцией, оформленной по циркуляционной схеме с одним потоком рецикла
1. Составить материальный баланс производства аммиака.
2. Определить массу газов рецикла, газов продувки и полную загрузку реактора.
3. Рассчитать фактические и теоретические расходные коэффициенты по сырью, выход аммиака по сырью при работе установки с рециркуляцией.
Исходные данные:
Производительность установки по аммиаку, т/год 25231,0
Число рабочих дней в году 340,0
Состав исходной смеси реагентов, % об.
Водород 74,6
Азот 24,9
Метан 0,5
Условия синтеза:
Температура, 0С 527
Давление, ат. 800
Содержание аммиака в газах рецикла, % об. 4,0
Содержание метана в газах продувки, % об. 5,0
Степень достижения равновесия 0,8×aР
Реакция синтеза:

Краткое описание синтеза:
Свежая азото-водородная смесь и газы рециркуляции поступают в колонну синтеза. Реакционная смесь, содержащая продукт реакции и непревращённые азот и водород, а также метан в качестве примеси сырья, проходит через холодильник и сепаратор, в котором разделяются на два потока: жидкий аммиак, отводимый в установки в качестве товарного продукта, и непревращённое сырьё. Последний поток делят на рецикл и поток продувки. Продувку, то есть сброс части рециркулируемой азото-водородной смеси, осуществляют во избежание накопления в рецикле примесей метана.
Расчёт баланса
1.  Составляем схему материальных потоков баланса:
Составляем схему материальных потоков баланса:
2. Для расчёта состава реакционной смеси решаем уравнение изотермы реакции синтеза для константы равновесия: 
3. Температурная зависимость КР описывается уравнением:

Рассчитываем значение КР для температуры синтеза Т = 527 + 273 = 800 К:


4. Находим равновесный и фактический составы равновесной смеси на основании стехиометрии реакции и уравнения изотермы КР (табл. 8). Расчёт производим для 100 м3 исходной азото-водородной смеси. Принимаем количество превращённого к моменту равновесия N2 за Х кмолей.
Таблица 22. Парциальные давления компонентов реакционной смеси
| Компонент | Исходная смесь | Равновесная смесь | |||
| м3 | кмоль | кг | кмоль | Р i | |
| Н2 | 74,6 | 74,6 : 22,4 = 3,333 | 3,333 × 2 = 6,666 | 3,333 – 3 × Х | 
|
| N2 | 24,9 | 24,9 : 22,4 = 1,111 | 1,111 × 28 = 31,108 | 1,111 - Х | 
|
| CH4 | 0,5 | 0,5 : 22,4 = 0,022 | 0,022 × 16 = 0,352 | 0,022 | - |
| NH3 | 0 | 0 | 0 | 2 × Х | 
|
| Итого | 4,466 | 
| 4,466 - 2 × Х | Р | |
5. Подставляем значения парциальных давлений Р i компонентов в уравнении изотермы реакции и решаем его относительно Х:


По условию конверсия N2 составляет 0,8 от равновесного значения. Следовательно, фактическое значение  кмоль.
кмоль.
6. Рассчитываем состав реакционной смеси после реактора (таблица 22).
7. Рассчитываем величины потоков газа 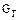 и товарного аммиака
и товарного аммиака 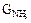 , выходящих из сепаратора. Газовый поток можно рассчитать исходя из 4 %-го содержания в нём несконденсировавшегося аммиака. Тогда на долю остальных компонентов (Н2, СН4 и N2) приходится 96 %:
, выходящих из сепаратора. Газовый поток можно рассчитать исходя из 4 %-го содержания в нём несконденсировавшегося аммиака. Тогда на долю остальных компонентов (Н2, СН4 и N2) приходится 96 %:
 кмоль, в том числе несконденсировавшегося аммиака
кмоль, в том числе несконденсировавшегося аммиака
 кмоль.
кмоль.
Поток товарного аммиака составит  кмоль
кмоль
Таблица 23. Фактический состав реакционной смеси
| Компонент | Равновесная смесь | ||
| кмоль | кг | Мас. доли | |
| Н2 | 3,333 – 3 × 0,541 = 1,71 | 1,71 × 2 = 3,42 | 3,42/38,126=0,0897 |
| N2 | 1,111 – 0,541 = 0,57 | 0,57 × 28 = 15,96 | 15,96/38,126=0,4186 |
| CH4 | 0,022 | 0,022 × 16 = 0,352 | 0,352/38,126=0,0093 |
| NH3 | 2 × 0,541 = 1,082 | 1,082 × 17 = 18,394 | 18,394/38,126=0,4824 |
| Итого: | 3,384 | 38,126 | 1,000 |
8. Газовый поток 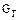 , выходящий из сепаратора, делится на два потока: поток рецикла
, выходящий из сепаратора, делится на два потока: поток рецикла  и поток газов продувки
и поток газов продувки  . Количество газов продувки за один проход через реактор определяем исходя из предельно допустимого по условиям синтеза содержания метана в газовом рецикле (5 %). При этом предполагается, что весь метан (0,022 кмоль), вошедший в реактор со свежей порцией сырья, полностью выдувается (0,022 кмоль составляет в абгазе 5 %, весь абгаз принят за 100 %):
. Количество газов продувки за один проход через реактор определяем исходя из предельно допустимого по условиям синтеза содержания метана в газовом рецикле (5 %). При этом предполагается, что весь метан (0,022 кмоль), вошедший в реактор со свежей порцией сырья, полностью выдувается (0,022 кмоль составляет в абгазе 5 %, весь абгаз принят за 100 %):  кмоль
кмоль
9. Для того, чтобы рассчитать массу газов продувки, необходимо знать состав газового потока, выходящего из сепаратора, который будет идентичен составу газов продувки и рецикла:
Таблица 24. Молярный состав газового потока
| Компоненты | кмоль | Масса, кг | Мол. доли |
| Н2 | 1,71 | 1,71 × 2 = 3,42 | 1,71/2,3979=0,7132 |
| N2 | 0,57 | 0,57 × 28 = 15,96 | 0,57/2,3979=0,23771 |
| CH4 | 0,022 | 0,022 × 16 = 0,35 | 0,022/2,3979=0,0091 |
| NH3 | 0,0959 | 0,0959 × 17 = 1,63 | 0,0959/2,3979=0,04 |
| Итого: | 2,3979 | 21,36 | 1,000 |
10. Определяем массу газов продувки. Результат записываем в табл. 25.
Таблица 25. Масса газов продувки (за один проход через реактор).
| Компоненты | Мол. доли | кмоль | Масса, кг |
| Н2 | 0,7132 | 0,7132 × 0,44 = 0,3138 | 0,3138 × 2 = 0,6276 |
| N2 | 0,2377 | 0,2377 × 0,44 = 0,1046 | 0,1046 × 2 = 2,9288 |
| CH4 | 0,0091 | 0,0091 × 0,44 = 0,0040 | 0,0040 × 16 = 0,064 |
| NH3 | 0,04 | 0,04 × 0,44 = 0,0176 | 0,0176 × 17 = 0,2992 |
| Итого: | 1,0000 | 0,44 | 3,9196 |
11. Рассчитываем массу газового рецикла, для чего из газов сепаратора вычитаем газы продувки (по каждому компоненту):  (табл. 26).
(табл. 26).
Таблица 26. Масса газового рецикла (за один проход через реактор)
| Компоненты | Масса, кг |
| Н2 | 3,42 – 0,6276 = 2,7924 |
| N2 | 15,96 – 2,9288 = 13,0312 |
| CH4 | 0,352 – 0,064 = 0,288 |
| NH3 | 1,63 – 0,2992 = 1,3308 |
| Итого: | 17,4424 |
12. Определяем массу товарного аммиака, получаемого при работе установки по прямой схеме (за один проход свежей порции сырья через реактор):  кг
кг
13. Для расчёта величины потоков сырья, рецикла, газов продувки и отводимого с установки продукта – товарного аммиака – находим коэффициент рециркуляции К R. С этой целью рассчитываем массовую долю рецикла в загрузке реактора (табл. 27).
Таблица 27. Массовая доля потоков, выходящих с установки за один проход через реактор
| Наименование потоков | Масса, кг | Массовая доля потока |
| Товарный аммиак | 16,7637 | 16,7637/38,126=0,4397 |
| Газы продувки | 3,9196 | 3,9196/38,126=0,1026 |
| Газовый рецикл | 17,4424 | 17,4424/38,126=0,4577 |
| Итого | 38,126 | 1,0000 |
14. Рассчитываем коэффициент рециркуляции К R:

15. Полная загрузка реактора при работе установки по циркуляционной схеме составит:
 кг
кг
16. Определяем количество газового рецикла:  кг
кг
17. Находим количество газов продувки при работе установки с рециркуляцией непревращённого сырья:  кг
кг
18. Рассчитываем выход аммиака при работе установки с рециркуляцией:

Тогда количество отводимого товарного аммиака составит:  кг
кг
19. Составляем материальный баланс синтеза аммиака на 100 м3 исходной смеси (свежего сырья) при работе установки с рециркуляцией газового потока:
Таблица 28. Материальный баланс синтеза аммиака на 100 м3 азото-водородной смеси
| Приход | Расход | ||||||
| № | Компоненты | кг/час | м3/ч | № | Компоненты | кг/час | м3/ча |
| 1. | Исходная смесь H2 N2 CH4 | 38,126 6,666 31,108 0,352 | 100 | 1. 2. | Товарный аммиак Газы продувки, H2 N2 CH4 NH3 | 30,9202 7,2058 1,1474 5,4026 0,118 0,5378 | 40,77 9,86 |
| 2. | Газы рециркуляции H2 N2 CH4 NH3 | 32,2165 5,1622 24,0526 0,5324 2,4693 | 3. | Газы рециркуляции, H2 N2 CH4 NH3 | 32,2165 5,1622 24,0526 0,5324 2,4693 | ||
| Итого: | 70,3425 | Итого: | 70,3425 | ||||
20. Для пересчёта баланса на заданную производительность установки требуется найти коэффициент пересчёта. Для этого находим часовую производительность установки:
 кг/час, затем коэффициент для пересчёта:
кг/час, затем коэффициент для пересчёта: 
21. Рассчитываем технологические показатели процесса производства:
а) теоретические расходные коэффициенты по сырью:
по водороду  т/т, по азоту
т/т, по азоту  т/т;
т/т;
б) фактические расходные коэффициенты по сырью:
по водороду  т/т, по азоту
т/т, по азоту  т/т;
т/т;
в) выход аммиака по сырью:
 %
%
Теоретический выход GТ рассчитывали исходя из поданного на установку водорода:
666,6 + 516,22 = 1182,82 кг
 кг
кг
Таблица 29. Материальный баланс производства аммиака в пересчёте на заданную производительность
| Приход | Расход | |||||||||||||||
| № | Компоненты | кг/час | м3/час | № | Компоненты | кг/час | м3/час | |||||||||
| 1. | Исходная смесь газов, в том числе: H2 N2 CH4 | 3812,6 666,6 3110,8 35,2 | 1000,0 | 1. 2. | Товарный аммиак Газы продувки, в том числе: H2 N2 CH4 NH3 | 3092,02 720,58 114,74 540,26 11,8 53,78 | 4077,0 986,0 | |||||||||
| 2. | Газы рециркуляции, в том числе: H2 N2 CH4 NH3 | 3221,65 516,22 2405,26 53,24 246,93 | 4386,0 | 3. | Газы рециркуляции, в том числе: H2 N2 CH4 NH3 | 3221,65 516,22 2405,26 53,24 246,93 | 4386,0 516,22 | |||||||||
| Итого: | 7034,25 | 14386,0 | Итого: | 7034,25 | ||||||||||||
|
из
5.00
|
Обсуждение в статье: Задача столь же легко решается, если в условиях задана производительность установки по продукту |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы
(0.01 сек.)


