 |
Главная |
Расчет материального баланса со сложной параллельной реакцией
|
из
5.00
|
1. Составить материальный баланс производства диалкилпиридина методом конденсации паральдегида с аммиаком.
2. рассчитать технологические показатели.
Краткое описание процесса
Раствор паральдегида в уксусной кислоте и аммиачную воду нагревают, и под давлением 5 МПа подают в контактный аппарат, где при 250°С протекают реакции образования алкилпиридинов.

(1)
(2)
Реакционную смесь охлаждают, и после отделения непревращенного аммиака подвергают ректификации для выделения продуктов.
Исходные данные:
Пропускная способность (нагрузка) установки по аммиаку, кг/час 3400,0
Состав аммиачной воды, % масс.
аммиак 30
вода 70
Конверсия аммиака, % 85
Мольное соотношение паральдегид: аммиак 1,05 : 1
Выход диалкилпиридина на превращенный аммиак, % 60
Потери аммиака, от исходного, % 1,0
Концентрация паральдегида в уксусной кислоте, %масс 50,0
Расчет баланса
Составляем схему материальных потоков для расчета баланса при работе по прямой схеме

Предварительные замечания:
- исходная смесь включает все компоненты, которые содержатся в поступающих в реактор потоках
- Реакционная смесь, покидающая реактор, содержит непревращенные реагенты, растворитель, инертные примеси сырья, целевые и побочные продукты
Из схемы материальных потоков определяем структуру материального баланса:

Здесь ПД – паральдегид, ДАП – диалкилпиридин, a-п и g-п – соответствующие пиколины, 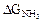 - потери аммиака. Штрихом помечены непревращенные количества реагентов.
- потери аммиака. Штрихом помечены непревращенные количества реагентов.
Решением задачи является определение абсолютных составов исходной и реакционной смесей, выраженных в кг/час. Расчет недостающих для баланса данных следует начать с составления баланса по определённому компоненту (в данном случае по аммиаку, т.к. для него известны исходное количество и конверсия).
Формирование исходной смеси проводим на основании заданного соотношения между основными реагентами с учетом концентраций NH3 в потоке аммиачной воды и паральдегида в уксуснокислом растворе. Основная проблема в стехиометрическом расчете состава реакционной смеси связана с распределением расхода аммиака на первую и вторую реакции.
НАПОМИНАЕМ, ЧТО ПРИ РАСЧЕТЕ МАТЕРИАЛЬНОГО БАЛАНСА ПАРАЛЛЕЛЬНЫХ РЕАКЦИЙ, НЕОБХОДИМО ВЫЧИСЛИТЬ РАСХОД РЕАГЕНТА НА ВСЕ РЕАКЦИИ, В КОТОРЫХ ЭТОТ РЕАГЕНТ УЧАСТВУЕТ.
Это распределение связано с относительными скоростями реакций: более быстрая реакция потребляет больше реагента в единицу времени по сравнению с медленной. Не используя кинетические параметры реакций задачу можно решить по значению выхода диалкилпиридина в первой реакции в расчете на превращенный аммиак. Таким образом, материальный баланс по аммиаку:
 ,
,
где  и
и  - массы непревращенного и превращенного (два штриха) аммиака, соответственно. В свою очередь масса превращенного аммиака состоит из количеств, пошедших на первую и вторую реакции, а также потерь:
- массы непревращенного и превращенного (два штриха) аммиака, соответственно. В свою очередь масса превращенного аммиака состоит из количеств, пошедших на первую и вторую реакции, а также потерь: 
Расчет составов исходной и реакционной смесей
1. Исходная смесь реагентов
Подано аммиачной воды из расчета 30%-ного содержания NH3 3400/0.3=11333 кг/час
1.2 В том числе воды 11333-3400=7933 кг/час
1.3 Подано аммиака, кмоль/час 3400/17=200 кмоль/час
1.4 Подано паральдегида в соответствии с заданным мольным соотношением
200×1,05=210 кмоль/час, что составляет 210×132=27720 кг/час
1.5 Подано раствора паральдегида из расчета его 50%-ного содержания
27720/0,5=55440 кг/час
1.6 Масса уксусной кислоты в растворе 55440-27720=27720 кг/час
2. Реакционная смесь. Ключевой компонент – аммиак. Решаем в киломолях.
2.1 Количество превращенного аммиака 200×0,85=170 кмоль/час
2.2 Непревращенный NH3 200-170=30 кмоль/час, или 30×17=510 кг/час
2.3 Количество аммиака, пошедшего на первую реакцию, определяем в три этапа:
сначала найдём теоретический выход диалкилпиридина  , считая, что весь превращенный аммиак израсходовался на образование этого продукта. По стехиометрии реакции из 3 кмоль NH3 образуется 3 кмоля диалкилпиридина, тогда из 170 кмоль превращенного аммиака должно теоретически получиться продукта также 170 кмоль, или
, считая, что весь превращенный аммиак израсходовался на образование этого продукта. По стехиометрии реакции из 3 кмоль NH3 образуется 3 кмоля диалкилпиридина, тогда из 170 кмоль превращенного аммиака должно теоретически получиться продукта также 170 кмоль, или  =170×121=20570 кг/час
=170×121=20570 кг/час
2.4 Фактически полученное количество диалкилпиридина определяем по выходу, заданному в условиях: 
 кг/час, или 12342/121=102 кмоль/час
кг/час, или 12342/121=102 кмоль/час
2.5 Теперь, зная, сколько диалкилпиридина образовалось в первой реакции, легко по стехиометрии вычислить количество NH3, израсходованного в этой реакции. Поскольку стехиометрические коэффициенты у NH3 и ДАП одинаковы, значит, если образовалось 102 кмоль ДАП, то и аммиака израсходуется 102 кмоль/час, или 102×17=1734 кг/час
2.6 Расход паральдегида в реакции 1 определяем из пропорции на основании стехиометрического уравнения:
На 3 кмоль NH 3 требуется 4 кмоль паральдегида
На 102 ¾ 
 =102×4/3=136 кмоль/час
=102×4/3=136 кмоль/час
2.7 Количество воды, полученной в реакции 1:
3 кмоль NH 3 дают 12 кмоль Н2О
102 кмоль NH 3 ¾ 
 =102×12/3=408 кмоль, или 408×18=7344 кг/час
=102×12/3=408 кмоль, или 408×18=7344 кг/час
2.8 Потери аммиака 200×0,01=2 кмоль/час, или 17×2=34 кг/час
2.9 Расход аммиака на вторую (побочную) реакцию определяем по разности – от общего количества превращенного реагента вычтем пошедшее на реакцию 1 и потери:
170-(102+2)=66 кмоль/час
2.10 Определяем расход паральдегида на реакцию 2. Поскольку стехиометрические коэффициенты у NH3 и паральдегида одинаковы, значит, что если израсходовалось 66 кмоль NH3, то и паральдегида израсходуется 66 кмоль/час.
2.11 Количество образовавшегося a-пиколина находим из пропорции на основании стехиометрического уравнения. В сокращенном виде - 66×1/2=33 кмоль/час, или 33×93=3069 кг/час
2.12 В этой реакции образуется столько же g-пиколина- 66×1/2=33 кмоль/час, или 33×93=3069 кг/час
2.13 Количество водорода, образовавшегося в реакции 2:
66×2/2=66 кмоль, или 66×2=132 кг/час
2.14 Количество воды, образовавшейся в реакции 2:
66×6/2=198 кмоль/час, или 198×18=3564 кг/час
2.15 Всего воды в реакционной смеси (образовалось в двух реакциях и подано с аммиачной водой): 7344+3564+7933=18841 кг/час
2.16 Всего израсходовалось паральдегида 136+66=202 кмоль/час
2.17 Непревращенный паральдегид 210-202=8 кмоль/час, или 132×8=1056кг/час.
3 Все величины, фигурирующие в материальном балансе, найдены, сводим в таблицу
4 Расчет технологических показателей
4.1 Общая конверсия паральдегида (отношение превращенного к поданному). Нужные цифры проще взять из таблицы материального баланса:

4.2 Избирательная конверсия (селективность) паральдегида по диалкилпиридину вычисляется как отношение реагента, пошедшего на целевую реакцию, ко всему превращенному. Из пункта 2.6 решения находим: на целевую реакцию израсходовалось 136 кмоль, или (136×132) кг паральдегида,

Таблица 15. Материальный баланс производства диалкилпиридина
| ПРИХОД | РАСХОД | ||||
| № п/п | Наименование компонента | кг/час | № п/п | Наименование компонента | кг/час |
| 1 | Аммиачная вода | 11333 | 1 | Диалкилпиридин | 12342 |
| в том числе: | 2 | a-пиколин | 3069 | ||
| а) аммиак | 3400 | 3 | g-пиколин | 3069 | |
| б) вода | 7933 | 4 | Водород | 132 | |
| 2 | Раствор паральдегида | 55440 | 5 | Вода | 18841 |
| в том числе: | 6 | Паральдегид | 1056 | ||
| а) паральдегид | 27720 | 7 | аммиак | 510 | |
| б) уксусная кислота | 27720 | 8 | Уксусная кислота | 27720 | |
| 9 | Потери аммиака | 34 | |||
| Итого | 66773 | Итого | 66773 | ||
4.3 Выход диалкилпиридина в расчете на поданный паральдегид.
Сначала на основании стехиометрического уравнения реакции1 вычислим теоретическое (максимально возможное) количество продукта, которое получится, если весь поданный в процесс паральдегид израсходуется только в целевой реакции:
Из 4 × 132 кг ПА образуется 3 × 121кг ДАП
Из 27720 кг ¾ 
 кг
кг
Тогда выход диалкилпиридина, 
4.4 Выход диалкилпиридина в расчете на превращенный паральдегид.
В этом случае теоретическое (максимально возможное) количество продукта, вычислим, исходя из превращенного реагента, используя стехиометрическое соотношение:
Из 4 × 132 кг ПА образуется 3 × 121кг ДАП
Из (27720-1056) кг ¾ 
 кг
кг
Тогда выход диалкилпиридина, 
4.5 Расходные коэффициенты по сырью
4.51 Теоретический расходный коэффициент по аммиаку определяем по стехиометрическому уравнению, в пересчете на аммиачную воду ( содержание аммиака – 30%)
 кг/кг
кг/кг
Фактический расходный коэффициент по аммиачной воде вычисляется по данным материального баланса:
 кг/кг
кг/кг
4.52 Теоретический расходный коэффициент по паральдегиду ( содержание реагента – 50%)
 кг/кг
кг/кг
Фактический расходный коэффициент по паральдегиду:
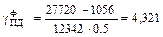 кг/кг
кг/кг
Расходные коэффициенты вычисляют так, как показано выше, в случае, если реагенты поступают не в чистом виде, а в составе сырья (в данном случае – в виде 30% -ных и 50% -ных растворов). Если же поступают чистые (100% -ные) реагенты, расчет упрощается:
 кг/кг
кг/кг  кг/кг
кг/кг
3.6.2.2 Расчёт материального баланса процесса со сложной параллельной реакцией
на основе её химической схемы и состава отходящих из реактора газов
Часто приходится сталкиваться с задачами, исходные данные для которых не столь подробны, как в предыдущем примере. В следующем примере показан алгоритм решения, когда известен состав отходящих газов, не содержащих целевого продукта. Такой метод применяется не только в параллельных реакциях, но и для процессов с любым механизмом.
Пример 23
1. Составить материальный баланс производства формальдегида окислением метанола кислородом воздуха.
2. Рассчитать технологические показатели процесса.
Исходные данные:
Производительность установки по формальдегиду, кг/×час 2550,0
Массовый состав метанола, % мас.
Метанол 95,0
Вода 5,0
Молярный состав сухих отходящих газов, % мол.
Азот 70,0
Водород 22,0
Углекислый газ 6,0
Метан 1,0
Кислород 1,0
Конверсия спирта, % 98
В процессе окисления протекают следующие реакции:

Краткое описание процесса:
Смесь паров метанола и воздуха поступает в контактный аппарат на окисление. Реакционная смесь охлаждается и поступает в делитель фаз, в котором разделяется на водный конденсат, содержащий, кроме воды, непревращённый спирт и формальдегид, и поток сухих отходящих газов.
Расчёт баланса
1. Составляем схему материальных потоков баланса:
Анализ схемы позволяет найти число потоков. Вход – потоки технического метанола и воздуха. Выход - поток водного конденсата, содержащего целевой продукт, и поток отходящих газов. Исходная информация содержит данные по составу трёх потоков (состав воздуха мы

помним). По условиям задачи следует рассчитать массу потоков на входе (приход) и выходе (расход) из реактора, для чего необходимо найти массу составляющих эти потоки компонентов, т.е. перейти от относительного состава потоков к абсолютному. Расчёт начинают, задаваясь величиной (массой, объёмом или количеством кмолей в зависимости от способа выражения состава: массового, объёмного или молярного) одного из потоков. Затем руководствуюсь законом стехиометрических соотношений, связывающим расход сырья с количеством получаемых продуктов, находят недостающие для баланса данные.
Анализ исходных данных позволяет выбрать в качестве основы для расчёта поток сухих отходящих газов как наиболее информативный, поскольку он содержит продукты всех четырёх реакций.
Расчёт на данном этапе решения задачи производят исходя из 100 киломолей сухих отходящих газов (задан молярный состав).
2. Рассчитываем массу потока сухих отходящих газов, результаты расчёта заносим в табл. 16
3. Рассчитываем массу потока воздуха, подаваемого на окисление. Задачу решаем, исходя из того, что 70 киломолей N2 попали в отходящие газы из воздуха. В свою очередь воздух представляет смесь N2 (79 %) и О2 (21 %). Следовательно, количество воздуха, поступающего в реактор, можно найти из следующего соотношения:
70 кмоль N 2 составляет – 79 %
Тогда воздух – 100 %
Таким образом, количество ( в кмоль/час) воздуха, поступающего в реактор: 
Напоминаем, что при расчёте составов количество смеси принимают за 100 %.
Тогда масса воздушного потока может быть определена как сумма N2 и О2:
N2 – 70 кмоль  кг/час О2 –
кг/час О2 –  кг/час
кг/час
Итого воздуха подается 1960+595,4432=2555,4432 кг/час
Таблица 16. Масса потока сухих отходящих газов
| Компоненты | % мол | Абсолютный состав газов | |
| кмоль/час | кг/час | ||
| N2 H2 CO2 CH4 O2 | 70,0 22,0 6,0 1,0 1,0 | 70,0 22,0 6,0 1,0 1,0 | 70 × 28 = 1960,0 22 × 2 = 44,0 6 × 44 = 264,0 1 × 16 = 16,0 1 × 32 = 32,0 |
| Итого: | 100,0 | 100,0 | 2316,0 |
4. Определяем расход кислорода на реакции 1, 3:  кмоль/час.
кмоль/час.
Расход определяется как разность между поступившим и оставшимся в отходящих газах кислородом.
5. Рассчитываем балансы реакций 1 и 2. Для этого следует определить, как распределяется кислород между ними. Найти расход О2 на реакцию 2 позволяет количество СО2 в абгазах, которое поставляет только эта реакция. В соответствии со стехиометрией реакции 2 на 1 кмоль СО2 расходуется 1,5 кмоля О2. Следовательно, для получения 6 кмолей СО2 следует затратить  кмолей О2. Тогда количество О2, израсходованного на реакцию 1, составит
кмолей О2. Тогда количество О2, израсходованного на реакцию 1, составит
 кмоль/час.
кмоль/час.
6. Рассчитываем расход метанола на реакции 1 – 4:
на реакцию 1:  кмоль/час (по расходу О2)
кмоль/час (по расходу О2)
на реакцию 2:  кмоль/час (по расходу H2: всего образовалось водорода 22 кмоль в отходящих газах и 1 кмоль израсходовался на реакцию 4).
кмоль/час (по расходу H2: всего образовалось водорода 22 кмоль в отходящих газах и 1 кмоль израсходовался на реакцию 4).
на реакцию 3:  кмоль/час (по количеству образовавшегося СО2)
кмоль/час (по количеству образовавшегося СО2)
на реакцию 4:  кмоль/час (по количеству образовавшегося метана)
кмоль/час (по количеству образовавшегося метана)
Всего метанола  кмоль/час
кмоль/час
7. Используя известное значение конверсии метанола (отношение превращенного к поданному) рассчитываем количество поступившего в реакцию метанола:
 кмоль/час или
кмоль/час или  кг/час
кг/час
(32 – молекулярная масса метанола).
Непревращённый метанол составляет  кг/час
кг/час
Поскольку в качестве сырья используют не 100 %-ный, а 95 %-ный метанол, масса потока технического метанола составит:  кг/час,
кг/час,
в том числе воды  кг/час
кг/час
8. Рассчитываем количество формальдегида (по расходу спирта на эти реакции):
по реакции 1:  кмоль/час
кмоль/час
по реакции 2:  кмоль/час
кмоль/час
Всего формальдегида образовалось  кмоль/час или
кмоль/час или  кг/час
кг/час
9. Определяем количество воды, полученной по реакциям 1, 3, 4 и поступившей в процесс вместе с техническим метанолом:
по реакции 1:  кмоль (по расходу метанола)
кмоль (по расходу метанола)
по реакции 3:  кмоль (по количеству СО2)
кмоль (по количеству СО2)
по реакции 4:  кмоль (по количеству метана)
кмоль (по количеству метана)
Всего воды образовалось  кмоль/час или
кмоль/час или  кг/час
кг/час
Общее количество воды в водном конденсате составит:  кг/час
кг/час
10. Определяем массу водного конденсата. Водный конденсат включает следующие компоненты: непревращённый метанол, формальдегид и воду:
 кг/час
кг/час
11. Составляем таблицу материального баланса:
Таблица 17. Материальный баланс производства формальдегида
(на 100 кмоль сухих отходящих газов)
| Приход | Расход | ||||
| № | Компоненты | кг/час | № | Компоненты | кг/час |
| 1. | 95 %-ный метанол, в том числе: Метанол Вода | 1622,864 1541,7208 81,1432 | 1. | Водный конденсат, в том числе: Формальдегид Метанол Вода | 1862,3072 1206,4560 30,8344 625,0168 |
| 2. | Воздух, в том числе: Кислород Азот | 2555,4432 595,4432 1960,0000 | 2. | Сухие отходящие газы, в том числе: Азот Кислород Водород Углекислый газ Метан | 2316,0000 1960,0000 326,0000 44,0000 264,0000 16,0000 |
| Итого: | 4178,3072 | Итого: | 4178,3072 | ||
12. Как видим, по нашему расчету формальдегида получается меньше, чем задано по условиям. Пересчитываем материальный баланс процесса на заданную производительность:
коэффициент пересчёта составит  . Каждую цифру таблицы 17 умножаем на этот коэффициент. Результаты пересчёта заносим в табл. 18.
. Каждую цифру таблицы 17 умножаем на этот коэффициент. Результаты пересчёта заносим в табл. 18.
13. Рассчитываем технологические показатели:
Общая конверсия по метанолу 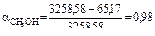 ;
;
Для того, чтобы найти избирательную конверсию (селективность), необходимо рассчитать расход метанола на получение 2550 кг формальдегида (х):
На 30 кг формальдегида расходуется 32 кг метанола
На 2550 кг — Х 
избирательная конверсия по метанолу 
Таблица 18. Материальный баланс производства формальдегида
в пересчёте на заданную производительность
| Приход | Расход | ||||
| № | Компоненты | кг/час | № | Компоненты | кг/час |
| 1. | 95 %-ный метанол, в том числе: Метанол Вода | 3430,0853 3258,5810 171,5042 | 1. | Водный конденсат, в том числе: Формальдегид Метанол Вода | 3936,1724 2550,0000 65,1706 1321,0018 |
| 2. | Воздух, в том числе: Кислород Азот | 5401,1847 1258,5287 4142,656 | 2. | Сухие отходящие газы, в том числе: Азот Кислород Водород Углекислый газ Метан | 4895,0976 4142,6560 67,6352 92,9984 557,9904 33,8176 |
| Итого: | 8831,2700 | Итого: | 8831,2700 | ||
- выход формальдегида по метанолу: 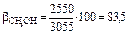 %
%
где 2550 – фактический выход формальдегида, 3055 – теоретический выход формальдегида, который находят из пропорции:
Из 32кг метанола образуется 30 кг формальдегида
Из 3258,58кг — G Т  кг.
кг.
- выход формальдегида на превращённый метанол:

где 2962,6 – теоретический выход формальдегида, рассчитанный исходя из количества превращённого формальдегида из аналогичной пропорции:

Расходные коэффициенты по сырью:
теоретические: по метанолу  т/т,
т/т,
по воздуху  т/т;
т/т;
фактические: по метанолу  т/т,
т/т,
по воздуху  т/т.
т/т.
3.6.2.3 Последовательная (консекутивная) реакция
При расчете материального баланса консекутивной реакции могут встретиться два случая: целевой продукт R является промежуточным:
A + B  Rц
Rц  S (1)
S (1)
Целевой продукт является конечным продуктом реакции:
A + B  S
S  Rц (2)
Rц (2)
3.6.2.4. Расчёт материального баланса процесса с консекутивной реакцией
и целевым промежуточным продуктом
В первом случае (реакция 1) фактически мы получим продукта R  , меньше его количества, образовавшегося по реакции A + B š Rц , поскольку некоторая часть его израсходуется в реакции Rц š S. Тогда материальный баланс реакции 1 запишется следующим образом:
, меньше его количества, образовавшегося по реакции A + B š Rц , поскольку некоторая часть его израсходуется в реакции Rц š S. Тогда материальный баланс реакции 1 запишется следующим образом:
 ,
,
где GA и GB - массы поступивших в процесс реагентов;
 ,
,  - массы непревращенных реагентов;
- массы непревращенных реагентов;
 ,
,  – массы продуктов реакции, Gp – потери. В свою очередь фактически полученный целевой продукт определяется по разности
– массы продуктов реакции, Gp – потери. В свою очередь фактически полученный целевой продукт определяется по разности  = GR1 – GR2 ,
= GR1 – GR2 ,
где GR1 и GR2 - массы целевого продукта R, образовавшегося в первой стадии и израсходованного во второй, соответственно.
Если исходные данные содержат значения GA , GB и конверсию реагента А или В, потери сырья или целевого продукта, а так же выход конечного продукта на поданное или превращенное сырьё, задачу решают по следующему алгоритму:
- находим количество превращенного реагента А (В): 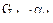
- по разности определяем количество непревращенного реагента: 
- потери реагента А (если заданы) определяем, взяв соответствующий % от превращенного реагента и вычитаем полученное количество Gp из превращенного сырья:  . Именно это количество реагента расходуется на стадию 1.
. Именно это количество реагента расходуется на стадию 1.
Если заданы потери целевого продукта R, то их величину находят только после вычисления GR1: GR1×%=Gp
- исходя из стехиометрии стадии 1 и величины GA1 ,находят общее количество продукта R, образовавшегося в этой стадии (GR1)
- по выходу  конечного продукта S находят его фактическое количество
конечного продукта S находят его фактическое количество  (напомним, что
(напомним, что  ). Теоретическое количество
). Теоретическое количество  находят из стехиометрии реакции А®S (как бы минуя промежуточный продукт). Для расчета используем массу поданного (превращенного) А за минусом потерь.
находят из стехиометрии реакции А®S (как бы минуя промежуточный продукт). Для расчета используем массу поданного (превращенного) А за минусом потерь.
- зная  по стехиометрии стадии 2 легко вычислить GR2 – количество промежуточного продукта, пошедшего на образование S.
по стехиометрии стадии 2 легко вычислить GR2 – количество промежуточного продукта, пошедшего на образование S.
- фактически полученное количество продукта R находят по разности:  = GR1 – GR2
= GR1 – GR2
- если заданы потери целевого продукта R, то фактическое его количество определяют из разности:  = GR1 – GR2 –Gp
= GR1 – GR2 –Gp
- расход второго реагента В находят из стехиометрии стадии 1, используя GA1.
Пример 24.
1. Составить материальный баланс процесса производства малеинового ангидрида воздушным окислением бензола.
2. Рассчитать технологические показатели процесса.
Краткое описание процесса:
Бензол испаряют, нагревают и смешивают с воздухом. Смесь поступает в контактный трубчатый реактор, где при температуре 4500С протекают реакции окисления.

Часть образовавшегося малеинового ангидрида взаимодействует с реакционной водой в образованием малеиновой кислоты.

малеиновый ангидрид малеиновая кислота
Реакционную массу охлаждают, сконденсировавшиеся продукты отделяются от абгаза и поступают на разделение.
Исходные данные:
Пропускная способность установки по бензолу, тыс. т/год 24,0
Конверсия бензола 0,96
Мольное соотношение бензол : кислород 1 : 6
Потери малеинового ангидрида, % мас. 1,0
Выход малеиновой кислоты на превращённый бензол, % 3,0
Расчёт баланса
 Составляем схему материальных потоков для определения числа потоков на входе и выходе, а также для уточнения недостающих для расчёта баланса данных.
Составляем схему материальных потоков для определения числа потоков на входе и выходе, а также для уточнения недостающих для расчёта баланса данных.
НАПОМИНАЕМ, ЧТО ФАКТИЧЕСКОЕ КОЛИЧЕСТВО (ВЫХОД) ЦЕЛЕВОГО ПРОДУКТА, КОТОРЫЙ ЯВЛЯЕТСЯ ПРОМЕЖУТОЧНЫМ В КОНСЕКУТИВНОЙ РЕАКЦИИ, МЕНЬШЕ, ЧЕМ ЕГО КОЛИЧЕСТВО, ОБРАЗОВАВШЕЕСЯ В РЕЗУЛЬТАТЕ ЦЕЛЕВОЙ РЕАКЦИИ, ИЗ-ЗА РАСХОДОВАНИЯ ЕГО В КОНЕЧНОЙ РЕАКЦИИ.
Для составления баланса необходимо рассчитать массы компонентов, входящих в состав трёх потоков: воздуха на входе и потоков реакционной массы и абгаза на выходе.
Анализ исходной информации показывает, что при расчёте недостающих для баланса данных следует начинать с определения количества превращённого по реакции 1 бензола, поскольку задана его конверсия. Стехиометрия реакции позволяет рассчитать расход кислорода и количества образующихся малеинового ангидрида и побочных продуктов. Далее, используя понятие выхода продукта на превращённое сырьё, можно найти массу малеиновой кислоты и на её основании рассчитать расход малеинового ангидрида на эту реакцию. Фактический выход малеинового ангидрида будет равен разности между образовавшимся по реакции 1 и израсходованным по реакции 2 малеиновым ангидридом.
Далее рассчитываем следующие величины:
1. Часовой расход бензола:
 кг/час или
кг/час или  кмоль/час
кмоль/час
где 340 – количество рабочих дней в году.
2. Количество превращённого бензола:  кмоль/час
кмоль/час
3. Количество непревращённого бензола:
 кмоль/час или
кмоль/час или  кг/час
кг/час
4. Часовой расход О2, который находим из заданного мольного соотношения
бензол : кислород:
 кмоль/час или
кмоль/час или  кг/час
кг/час
5. Часовой расход (подано) воздуха:
 кмоль/час, в том числе азота:
кмоль/час, в том числе азота:
 кмоль/час, или
кмоль/час, или 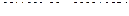 кг/час.
кг/час.
Всего расход воздуха составит О2 + N2 = 7239,81504 + 23831,0576 = 31070,88 кг/час.
6. Малеинового ангидрида по стехиометрии реакции 1 образуется столько же, сколько расходуется бензола: 36,19927 кмоль/час
7. Образуется СО2 по реакции 1:  кг/час
кг/час
8. Образуется Н2О по реакции 1:  кмоль/час
кмоль/час
9. Расход О2 на реакцию 1:  кмоль/час
кмоль/час
10. Количество непревращённого кислорода:
 кмоль/час, или
кмоль/час, или  кг/час
кг/час
11. Количество малеиновой кислоты, образовавшейся по реакции 2, находим из следующих соображений:
По стехиометрии обеих реакций, 1 кмоль бензола даёт 1 кмоль кислоты. Поскольку количество превращённого бензола составляет 36,19927 кмоль×ч-1, теоретический выход кислоты, исходя из превращённого бензола, будет также равен 36,19927 кмоль×ч-1. Следовательно, фактический выход кислоты (см. условия) составит 3 % от теоретического:
 кмоль/час или
кмоль/час или  кг/час.
кг/час.
12. Малеинового ангидрида на реакцию 2 израсходовалось столько же, сколько образовалось кислоты: 1,0859781 кмоль/час
13. Фактически образовалось малеинового ангидрида:
36,19927-1,0859781=35,1132919 кмоль/час, или 35,1132919×98=3441,102 кг/час
14. Потери малеинового ангидрида: 3441,102×0,01=34,41кг/час
15. Фактически образовалось малеинового ангидрида с учетом потерь:
3441,102-34,41=3406,692 кг/час
16. Расход воды на реакцию 2 такой же, как и малеинового ангидрида 1,08598 кмоль/час
17. Количество воды в реакционной смеси:  кг/час
кг/час
18. Составим таблицу материального баланса
Таблица 18. Материальный баланс производства малеинового ангидрида
| Приход | Расход | ||||
| № | Компоненты | кг/час | № | Компоненты | кг/час |
| 1. | Бензол | 2941,17 | 1. | Малеиновый ангидрид | 3406,69 |
| 2. | Воздух, в том числе а) кислород б) азот | 31070,88 | 2. | Малеиновая кислота | 125,97 |
| 7239,82 | 3. | Бензол | 117,63 | ||
| 23831,06 | 4. | Вода | 1283,63 | ||
| 5. | Абгаз, в том числе: Кислород Азот Углекислый газ | 2027,12 23831,06 3185,54 | |||
| 6. | Потери ангидрида | 34,41 | |||
| Итого: | 34012,05 | Итого: | 34012,05 | ||
18. Рассчитываем технологические показатели:
- общая конверсия бензола  %;
%;
- избирательная конверсия бензола в малеиновый ангидрид или селективность по малеиновому ангидриду. Сначала вычислим количество бензола, пошедшего на образование фактического количества малеинового ангидрида (МА):
98 кг МА образуется из 78 кг С6Н6
3406,69кг МА — из Х Х = 2711,45 кг, и отнесём его к превращенному бензолу:
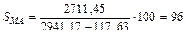 %
%
- выход малеинового ангидрида в расчете на поданный бензол вычисляем как отношение фактически полученного ангидрида к теоретически возможному: %
Из 78 кг С6Н6 образуется 98 кг МА
Из 2941,17 кг —  Здесь
Здесь  = 3823,54– теоретический выход ангидрида, рассчитанный исходя из поданного в процесс бензола. Тогда вых
= 3823,54– теоретический выход ангидрида, рассчитанный исходя из поданного в процесс бензола. Тогда вых
|
из
5.00
|
Обсуждение в статье: Расчет материального баланса со сложной параллельной реакцией |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

