 |
Главная |
Расчет состава реакционной смеси
|
из
5.00
|
При расчете состава смеси, получаемой в результате протекания химической реакции, пользуются законом стехиометрических соотношений:
Вещества реагируют друг с другом в соотношениях, равных их стехиометрическим коэффициентам в уравнении.
Так, для реакции SO2 + 0,5 O2 D SO3, если прореагирует 1 киломоль SO2, то кислорода прореагирует 0,5 киломоля и образуется 1 киломоль SO3. Аналогично, если вступит в реакцию 5 киломолей SO2, то кислорода прореагирует 2,5 киломолей, и появится 5 киломолей SO3.
Состав реакционных смесей невозможно вычислить без знания величины конверсии реагентов.
Слово «конверсия» означает превращение. Различают общую и избирательную конверсии.
Общая конверсия служит оценкой глубины протекания реакции или, что то же самое, степени использования реагента. Измеряется конверсия долей превращённого реагента от поданного, причём количество поданного реагента может быть принято за 100 % (тогда значение конверсии выражается в процентах) либо за единицу (тогда получают значение конверсии в долях от целого). Таким образом, конверсия может изменяться в пределах от 0 до 1 или от 0 до 100 %. Величина конверсии 70% означает, что в реакцию вступило 70% поданного в реактор реагента А, а 30% осталось непревращенным. На входе потока в реактор значение aА = 0. Конверсия aА = 1 означает, что реагент А прореагировал полностью и его содержание в потоке на выходе из реактора будет равно нулю. Отметим, что в промышленности конверсии по разным причинам практически никогда не достигают 100%. Конверсию обозначают Х или a и рассчитывают обычно по одному из реагентов, (как правило, более дорогому), который называют ключевым, поскольку, зная его конверсию, содержание остальных компонентов реакционной смеси легко найти по стехиометрическим коэффициентам. Тогда для реакции А + В®R + S можно рассчитать конверсию по А или по В:
 (2.1)
(2.1)
 (2.2)
(2.2)
Следует отметить, что конверсия по А не равна конверсии по В. Это равенство может наблюдаться только в частном случае, когда равны исходные концентрации А и В и их стехиометрические коэффициенты. Чтобы рассчитать конверсию А из материального баланса, следует определить количество превращённого (исчезнувшего в ходе процесса) А. С этой целью находят в приходной части баланса количество поданного в процесс «чистого», т.е. без примесей, А и вычитают из него остаток А, приведённый в расходной части баланса.
Общую конверсию можно также рассчитать, используя значения концентраций реагентов.  (2.3),
(2.3),
где СА0 – начальная концентрация реагента А; СА – текущая концентрация реагента А. Разность, стоящая в числителе, равна количеству превращённого реагента А:
 (2.4)
(2.4)
Количество непревращённого реагента А можно получить, решив уравнение (33) относительно СА:
 (2.5)
(2.5)
Если реакция протекает с изменением объёма, в уравнение для расчёта конверсии следует включить поправочный коэффициент на изменение объёма e:
 (2.6)
(2.6)
Расчет состава реакционной смеси следует начинать с определения её качественного состава, а затем переходить к расчету количеств.
Пример 15.
При различных соотношениях и конверсиях реагентов определить качественный состав реакционной смеси для реакции
4NH3 + 5O2 ® 4NO + 6H2O
а) Реагенты загружают в мольном соотношении NH3 : О2 = 4 : 5, конверсия  = 1
= 1
В этом случае реакционная смесь будет содержать только продукты NO и H2O, поскольку реагенты загружены в стехиометрическом соотношении и полное превращение одного реагента повлечет за собой полную конверсию другого.
б) Реагенты загружают в мольном соотношении NH3 : О2 = 4 : 8, конверсия  = 1
= 1
Теперь реакционная смесь содержит продукты NO и H2O, а так же О2, поскольку он взят в избытке и если прореагируют все 4 киломоля NH3, то в реакцию войдет только 5 киломолей О2.
в) Реагенты загружают в мольном соотношении NH3 : О2 = 4 : 5, конверсия  = 0,8.
= 0,8.
Реакционная смесь содержит как продукты, так и оба непревращенных реагента.
На нескольких примерах покажем алгоритм расчета реакционных смесей.
Пример 16.
Рассчитать молярный и массовый составы реакционной смеси для реакции
2H2S + 3O2 ® 2SO2 + 2H2O
Реагенты подают в реактор в стехиометрическом соотношении H2S : O2 = 2 : 3 (моль).
Конверсия сероводорода  =10%.
=10%.
Решение
1. Поскольку загрузка реагентов никак не задана, можно принять, что в реактор поступает 2 кмоль H2S и 3 кмоль O2.
2. Результаты расчета заносим прямо в таблицу в виде математических действий.
Таблица 9. Расчет состава реакционной смеси
| Компонент | Исходная смесь | Реакционная смесь | |||
| кмоль | кмоль | % моль | кг | % мас | |
| H2S | 2 | 2-2×0,1=1,8 | 1,8×100/4,9=36,76 | 1,8×34=61,2 | 61,2×100/164=37,317 |
| O2 | 3 | 3-0,3=2,7× | 2,7×100/4,9=55,1 | 2,7×32=86,4 | 86,4×100/164=52,683 |
| SO2 | - | 0,2 | 0,2×100/4,9=4,082 | 0,2×64=12,8 | 12,8×100/164=7,805 |
| H2O | - | 0,2 | 0,2×100/4,9=4,082 | 0,2×18=3,6 | 3,6×100/164=2,195 |
| Итого | 5 | 4,9 | 100,0 | 164,0 | 100,0 |
3. Определяем количество превращенного H2S: 2×0,1= 0,2 кмоль
4. Тогда непревращенный H2S: 2-0,2=1,8 кмоль
5. Для кислорода конверсия не указана, поэтому превращенный O2 находим из пропорции на основании стехиометрического уравнения:
2 кмоля H 2 S требуют расхода 3 кмоль O 2
0,2 кмоль - Х кмоль Х = 0,2×3/2= 0,3 кмоль
6. Непревращенный кислород 3-0,3=2,7
7. Количества образовавшихся продуктов в соответствии со стехиометрией равны количеству превращенного H2S, т.е SO2 и H2O образовалось по 0,2 кмоль.
В предыдущем примере мы работали с чистыми, (100%-ными) реагентами без примесей. Следующий пример показывает расчет состава реакционной смеси, когда поступающие в процесс потоки сырья содержат не только реагенты, но и примеси.
Пример 17.
Рассчитать в % мас состав реакционной смеси для реакции
SO2 + 0,5 O2 ® SO3
В качестве сырья используют печной газ (техническое название), который поступает из печей обжига колчедана, и воздух.
Состав печного газа, % моль: SO2 –7; O2 – 11; N2 - 82
Состав воздуха, % моль: O2 –21; N2 – 79
Реагенты загружают в мольном соотношении SO2 : O2 = 1 : 2.
Конверсия диоксида серы  =80%
=80%
Решение
1. Составляем схему материальных потоков и определим качественный состав потоков на входе и выходе из реактора.
 |
2. Печной газ, как и воздух в качестве примеси содержит азот, который в реакции не участвует и переходит в реакционную смесь в неизменном виде. В этой смеси кроме продукта SO3 имеются непревращенный SO2 и O2, поскольку конверсия диоксида серы не полная, а кислород, к тому же, взят в избытке против стехиометрии.
Поскольку количества печного газа и воздуха неизвестны, можно задаться величиной одного из потоков. Выбирают наиболее информативный поток (в нашем случае это печной газ). Расчет удобнее провести исходя из 100 кмоль печного газа.
3. Поток воздуха следует подмешать к печному газу в соответствии с заданным соотношением реагентов, которое должно поддерживаться в исходной смеси. Поскольку количество диоксида серы в печном газе составляет 100×0,07 = 7 кмоль, то количество O2 в исходной смеси должно составлять 2×7 =14 кмоль. Следовательно, к 100×0,11 = 11 кмоль кислорода, имеющимся в печном газе, дополнительные 3 кмоля O2 должны придти с воздухом. Тогда воздуха следует подать 3/0,21 = 14,3 кмоля. Как вы понимаете, здесь скрыта пропорция: 3 кмоля O2 составляют 21% от воздуха, тогда весь воздух – 100%. Азот, поступающий в составе воздуха можно определить по разности 14,3 – 3 = 11,3 кмоль, либо взять 79% от 14,4 т.е. 14,3×0,79 = 11,3 кмоль. Тогда всего азота поступает в реактор и покидает его в неизменном виде:
100×0,82 (в печном газе) + 11,3 (с воздухом) = 93,3 кмоль.
4. Покончив с исходной смесью, переходим к реакционной. Начнем с реагентов.
Количество превращенного SO2 = 7×0,8 = 5,6 кмоль, непревращенного = 7 – 5,6 = 1,4 кмоль.
Превращенный кислород в соответствии со стехиометрией составит 0,5×5,6 = 2,8 кмоль. По разнице между поданным и превращенным определим количество непревращенного O2 = 14-2,8 = 11,2 кмоль.
5. В соответствии с коэффициентами уравнения реакции, SO3 образуется столько же, сколько превратилось SO2, т.е. 5,6 кмоль. Результаты расчета сводим в таблицу.
Таблица 10. Расчет состава реакционной смеси
| Компонент | Исходная смесь | Реакционная смесь | ||
| кмоль | кмоль | кг | % мас | |
| SO2 | 7 | 7-0,8×7=1,4 | 1,4×64=84,6 | 84,6×100/3508,4=2,554 |
| N2 | 82+11,3=93,3 | 93,3 | 93,3×28=2612,4 | 2612,4×100/3508,4=74,461 |
| O2 | 11+3=14 | 14-0,5×5,6=11,2 | 11,2×32=358,4 | 358,4×100/3508,4=10,215 |
| SO3 | - | 5,6 | 5,6×80=448 | 448×100/3508,4=12,77 |
| Итого | 114,3 | 111,5 | 3508,4 | 100,0 |
ВНИМАНИЕ. Все предыдущие расчеты состава были выполнены для стандартного состояния системы (температура 273 К, давление 9,8×104 н/м2). Однако химические реакции и другие процессы химической технологии могут протекать при самых разнообразных условиях, далеких от стандартных. Поэтому объемы газообразных смесей отличаются от определенных для стандартных условий, что сказывается и на мольно-объемных концентрациях (моль/л, кмоль/м3) которые широко применяются в химической кинетике и в проектировании реакторов.
Пример 18.
Рассчитать мольно-объемную концентрацию компонентов реакционной смеси для рабочих условий и стандартного состояния для реакции:
NO + 0.5O2 ® NO2
Реакция протекает в газах, выходящих из реактора окисления аммиака и имеющих следующий состав (% моль): NO – 9,0; NO2 – 1,0; N2 – 82,0; O2 – 8,0.
Условия реакции: температура 20°С, давление 19,6×104 н/м2. Конверсия оксида азота 
Решение.
1. Составим схему материальных потоков:
 |
ВНИМАНИЕ. А). В исходной смеси уже содержится продукт реакции NO2.
б). Реакция протекает с уменьшением объема.
в). Задаемся количеством исходной смеси газов 100 кмоль
2. По уже известному алгоритму вычисляем составы исходной и реакционной смесей, и результаты заносим в таблицу:
Таблица 11. Расчет состава реакционной смеси
| Компонент | Исходная смесь | Реакционная смесь | ||
| кмоль | кмоль | (кмоль/м3)×104 | (кмоль/м3)×104 | |
| стандартные условия | рабочие условия | |||
| NO | 9 | 9-0,8×9=1,8 | 8,34 | 15,53 |
| O2 | 8 | 8-0,5×(0,8×9)=4,4 | 20,38 | 37,97 |
| N2 | 82 | 82 | 379,74 | 707,64 |
| NO2 | 1 | 1+7,2=8,2 | 37,97 | 70,76 |
| Итого | 100 | 96,4 | ||
3. Находим объем реакционной смеси в стандартных условиях:
V0 = 96,4×22,4=2159,36 м3.
4. Для определения объема при рабочих температуре и давлении используем формулу приведения:  , (2.7)
, (2.7)
где P, V, T и P0, V0, T0 – параметры системы в рабочем и стандартном состоянии. Тогда объем реакционной смеси составит:
 м3.
м3.
5. Молярная концентрация оксида азота в стандартных условиях:

6. Молярная концентрация оксида азота в рабочих условиях:

7. Аналогично вычисляют концентрации остальных компонентов реакционной смеси.
Контрольные задания
1. В реакторе протекает реакция окисления метана
СН4 + 0,5О2 ® СН3ОН
Реагенты загружают в мольном соотношении СН4 :О2 = 9 : 1
Состав метансодержащего газа, % мас: метан – 95; азот - 5
Состав технического кислорода, % моль: кислород – 80; азот - 20
Рассчитать состав реакционной смеси в % мас, % моль и кмоль/м3 для конверсии кислорода, равной 80%.
2. В реакторе протекает реакция хлорирования метана
СН4 +Cl2 ® СН3Cl + HCl
Реагенты загружают в мольном соотношении СН4 :Cl2 = 3 : 1
Состав природного газа, % моль: СН4 – 98; С2Н6 – 2. Этан считать инертной примесью.
Состав технического хлора, % мас: Cl2 –95; О2 – 5
Рассчитать состав реакционной смеси в % мас, % моль и кмоль/м3 для конверсии хлора 95%.
3. Составить схему материальных потоков для смесителя и реактора, рассчитать составы исходной и реакционной смесей в % мас, % моль и кмоль/м3, определить массовые расходы реагентов и реакционной смеси для реакции карбонилирования ацетилена
2С2Н2 + 2СО + Н2 ®НО-(С6Н4)-ОН
Таблица 12 Исходные данные к контрольным заданиям:
| № п/п | 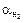
| Подача смеси, кг/час | Мольное соотношение реагентов |
| 1 | 0,1 | 620 | С2Н2 : СО : Н2 =2,7 : 1,2 : 1 |
| 2 | 0,4 | 800 | С2Н2 : СО : Н2 = 2,5 : 1 : 1 |
| 3 | 0,2 | 550 | С2Н2 : СО : Н2 = 2 : 0,8 : 1 |
| 4 | 0,3 | 1000 | С2Н2 : СО : Н2 = 2,9 : 1 : 1 |
| 5 | 0,2 | 600 | С2Н2 : СО : Н2 =3,8 : 0,9 : 1 |
| 6 | 0,2 | 700 | С2Н2 : СО : Н2 = 2,1 : 1 : 1 |
| 7 | 0,3 | 500 | С2Н2 : СО : Н2 =4 : 1,5 : 1 |
| 8 | 0,3 | 680 | С2Н2 : СО : Н2 = 2,3 : 1 : 0,8 |
| 9 | 0,1 | 400 | С2Н2 : СО : Н2 = 3,3 : 0,9 : 0,8 |
| 10 | 0,3 | 980 | С2Н2 : СО : Н2 = 2,5 : 1,2 : 1 |
| 11 | 0,4 | 1500 | С2Н2 : СО : Н2 = 2,7 : 1,3 : 1 |
| 12 | 0,2 | 1200 | С2Н2 : СО : Н2 = 2,6 : 0,8 : 1 |
| 13 | 0,2 | 500 | С2Н2 : СО : Н2 = 2,9 : 1,4 : 1 |
| 14 | 0,4 | 740 | С2Н2 : СО : Н2 = 4 : 1,8 : 1 |
| 15 | 0,6 | 740 | С2Н2 : СО : Н2 = 3 : 2 : 1 |
| 16 | 0,5 | 820 | С2Н2 : СО : Н2 = 3,1 : ,9 : 1 |
| 17 | 0,2 | 460 | С2Н2 : СО : Н2 = 3 : 1,5 : 1 |
| 18 | 0,5 | 490 | С2Н2 : СО : Н2 = 3 : 1,4 : 1 |
| 19 | 0,3 | 880 | С2Н2 : СО : Н2 = 3,2 : 1,1 : 1 |
| 20 | 0,4 | 280 | С2Н2 : СО : Н2 = 3,4 : 0,7 : 0,7 |
| 21 | 0,3 | 650 | С2Н2 : СО : Н2 = 3,3 : 1,4 : 1 |
| 22 | 0,4 | 750 | С2Н2 : СО : Н2 = 2,2 : 0,9 : 0,9 |
| 23 | 0,25 | 1600 | С2Н2 : СО : Н2 = 3,5 : 1,6 : 1 |
| 24 | 0,4 | 750 | С2Н2 : СО : Н2 = 2,2 : 0,9 : 1 |
| 25 | 0,6 | 800 | С2Н2 : СО : Н2 = 2,8 : 1,2 : 1 |
|
из
5.00
|
Обсуждение в статье: Расчет состава реакционной смеси |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

