 |
Главная |
Свойства вещества вблизи абсолютного нуля. Третье начало термодинамики. Абсолютная энтропия.
|
из
5.00
|
46. Реальные газы. Уравнение Ван-дер-Ваальса. Изотермы газа Ван-дер-Ваальса. Критический объем, давление и температура. Внутренняя энергия газа Ван-дер-Ваальса.
В термодинамике под реальным газом, понимается газ, который не описывается в точности уравнением Клапейрона — Менделеева, в отличие упрощенной его модели — гипотетического идеального газа, строго подчиняющегося вышеуказанному уравнению. Обычно под реальным газом понимают газообразное состояние вещества во всем диапазоне его существования.
Учет притяжения молекул. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е.
p' = a/V2m,
где а— постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, Vm — молярный объем.
Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):
(p+a/V2m)(Vm-b)=RT.
 Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса — кривые зависимости р от Vm при заданных Т, определяемые уравнением Ван-дер-Ваальса (61.2) для моля газа. Эти кривые (рассматриваются для четырех различных температур; рис. 89) имеют довольно своеобразный характер. При высоких температурах (T>Tк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Тк на изотерме имеется лишь одна точка перегиба К. Эта изотерма называется критической, соответствующая ей температура Tк — критической температурой. Критическая изотерма имеет лишь одну точку перегиба К, называемую критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vки давление рк называются также критическими. Состояние с критическими параметрами (рк, Vк , Тк) называется критическим состоянием. При низких температурах (Т<Тк) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса — кривые зависимости р от Vm при заданных Т, определяемые уравнением Ван-дер-Ваальса (61.2) для моля газа. Эти кривые (рассматриваются для четырех различных температур; рис. 89) имеют довольно своеобразный характер. При высоких температурах (T>Tк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Тк на изотерме имеется лишь одна точка перегиба К. Эта изотерма называется критической, соответствующая ей температура Tк — критической температурой. Критическая изотерма имеет лишь одну точку перегиба К, называемую критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vки давление рк называются также критическими. Состояние с критическими параметрами (рк, Vк , Тк) называется критическим состоянием. При низких температурах (Т<Тк) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.



47. Основные положения молекулярно-кинетической теории. Давление газа и температура. Теорема о равномерном распределении кинетической энергии по степеням свободы. Число степеней свободы – это число независимых величин с помощью которых может быть задано положение системы. (1 атом =3 ст., 2 атома =5ст. 3 атома=6ст.)
Молекулярно-кинетическая теория (сокращённо МКТ) — теория, рассматривающая строение вещества с точки зрения трёх основных приближенно верных положений:
1) все тела состоят из частиц, размером которых можно пренебречь: атомов, молекул и ионов;
2) частицы находятся в непрерывном хаотическом движении (тепловом);
3) частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: 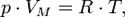
где
 —давление,
—давление,
— молярный объём,
 —универсальная газовая постоянная
—универсальная газовая постоянная
— абсолютная температура,К.
Так как 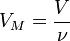 , где
, где  — количество вещества, а
— количество вещества, а  , где
, где  — масса,
— масса,  — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать: 
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
48. Броуновское движение. Формула Эйнштейна. Смещение частицы в пространстве.
Бро́уновское движе́ние (бра́уновское движе́ние) — беспорядочное движение микроскопических видимых взвешенных в жидкости или газе частиц твёрдого вещества, вызываемое тепловым движением частиц жидкости или газа. Было открыто в 1827 году Робертом Броуном (правильнее Брауном)[1]. Броуновское движение никогда не прекращается. Оно связано с тепловым движением, но не следует смешивать эти понятия. Броуновское движение является следствием и свидетельством существования теплового движения.
В 1905 году Альбертом Эйнштейном была создана молекулярно-кинетическая теория для количественного описания броуновского движения[11]. В частности, он вывел формулу для коэффициента диффузии сферических броуновских частиц:



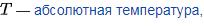



 ,где
,где  –диффузионная постоянная, и выполняется
–диффузионная постоянная, и выполняется  , где
, где  – время релаксации движения частицы под действием трения.
– время релаксации движения частицы под действием трения.
Смещение x частицы происходит с течением времени хаотически из-за ударов микрочастиц, совершающих тепловые движения. На частицу в жидкости действует сила вязкого трения, пропорциональная ее скорости

|
из
5.00
|
Обсуждение в статье: Свойства вещества вблизи абсолютного нуля. Третье начало термодинамики. Абсолютная энтропия. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

