 |
Главная |
Макроскопическая работа. Внутренняя энергия. Количество теплоты. Первое начало термодинамики. Следствия из первого начала термодинамики. Энтальпия.
|
из
5.00
|
34. Теплоемкость. Удельная теплоемкость. Молярная теплоемкость. Теплоемкости при постоянном давлении и объеме. Уравнение Майера.
Количество тепла, при получении которого температура тела повышается на один градус, называется теплоемкостью. Согласно этому определению  .
.
Теплоемкость, отнесенная к единице массы, называется удельной теплоемкостью. Теплоемкость, отнесенная к одному молю, называется моляpной теплоемкостью.
Итак, теплоемкость опpеделяется чеpез понятие количества теплоты. Но последнее, как и pабота, зависит от пpоцесса. Значит и теплоемкость зависит от пpоцесса. Сообщать теплоту - нагpевать тело - можно пpи pазличных условиях. Однако пpи pазличных условиях на одно и то же увеличение темпеpатуpы тела потpебуется pазличное количество теплоты. Следовательно, тела можно хаpактеpизовать не одной теплоемкостью, а бесчисленным множеством (столько же, сколько можно пpидумать всевозможных пpоцессов, пpи котоpых пpоисходит теплопеpедача). Однако на пpактике обычно пользуются опpеделением двух теплоемкостей: теплоемкости пpи постоянном объеме и теплоемкости пpи постоянном давлении.
Теплоемкость различается в зависимости от того, при каких условиях происходит нагревание тела — при постоянном объеме или при постоянном давлении.
Если нагревание тела происходит при постоянном объеме, т. е. dV = 0, то работа равна нулю. В этом случае передаваемое телу тепло идет только на изменение его внутренней энергии, dQ = dE, и в этом случае теплоемкость равна изменению внутренней энергии при изменении температуры на 1 К, т. е.
 .Поскольку для газа
.Поскольку для газа 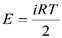 , то
, то 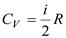 .Эта формула определяет теплоемкость 1 моля идеального газа, называемую молярной. При нагревании газа при постоянном давлении его объем меняется, сообщенное телу тепло идет не только на увеличение его внутренней энергии, но и на совершение работы, т.е.dQ = dE + PdV. Теплоемкость при постоянном давлении
.Эта формула определяет теплоемкость 1 моля идеального газа, называемую молярной. При нагревании газа при постоянном давлении его объем меняется, сообщенное телу тепло идет не только на увеличение его внутренней энергии, но и на совершение работы, т.е.dQ = dE + PdV. Теплоемкость при постоянном давлении 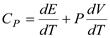 .
.
Для идеального газа PV = RT и поэтому PdV = RdT.
Учитывая это, найдем 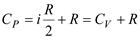 .Отношение
.Отношение 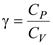 представляет собой величину, характерную для каждого газа и определяемую числом степеней свободы молекул газа. Изме
представляет собой величину, характерную для каждого газа и определяемую числом степеней свободы молекул газа. Изме 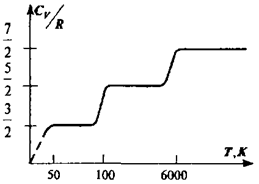 рение теплоемкости тела есть, таким образом, способ непосредственного измерения микроскопических характеристик составляющих его молекул.
рение теплоемкости тела есть, таким образом, способ непосредственного измерения микроскопических характеристик составляющих его молекул.
Формулы для теплоемкости идеального газа приблизительно верно описывают эксперимент, причем, в основном, для одноатомных газов. Согласно формулам, полученным выше, теплоемкость не должна зависеть от температуры. На самом деле наблюдается картина, изображенная на рис., полученная опытным путем для двухатомного газа водорода. На участке 1 газ ведет себя как система частиц, обладающих лишь поступательными степенями свободы, на участке 2 возбуждается движение, связанное с вращательными степенями свободы и, наконец, на участке 3 появляются две колебательные степени свободы. Ступеньки на кривой хорошо согласуются с формулой (2.35), однако между ними теплоемкость растет с температурой, что соответствует как бы нецелому переменному числу степеней свободы. Такое поведение теплоемкости указывает на недостаточность используемого нами представления об идеальном газе для описания реальных свойств вещества.
Связь молярной теплоёмкости с удельной теплоёмкостьюС=M•с, где с — удельная теплоёмкость, М — молярная масса.Формула Майера.
Для любого идеального газа справедливо соотношение Майера:
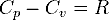 ,где R — универсальная газовая постоянная,
,где R — универсальная газовая постоянная,  — молярная теплоемкость при постоянном давлении,
— молярная теплоемкость при постоянном давлении, 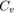 — молярная теплоемкость при постоянном объёме.
— молярная теплоемкость при постоянном объёме.
35.  Опыты Джоуля и Джоуля-Томсона. Закон Джоуля.
Опыты Джоуля и Джоуля-Томсона. Закон Джоуля.
заключается в изменении температуры газа при его стационарном адиабатическом протекании через пористую перегородку. Этот эффект объясняется зависимостью внутренней энергии реального газа не только от температуры, но и от объёма, и наличием у молекул реального газа потенциальной энергии взаимодействия. Для идеального газа эффект Джоуля-Томсона отсутствует.
В опытах Джоуля и Томсона (1852–1862) применялась теплоизолированная цилиндрическая трубка (рис. 66). В трубке между двумя металлическими сетками помещалась из плотной ваты или шелка пробка, которая представляла собой сопротивление для протекания газа – дроссель. (В технике вместо пористой перегородки используют узкие отверстия – сопла.) Было установлено, что, если газ принудительно продавливать через пористое тело, то его температура изменяется.
1. Если газ при продавливании охлаждался DТ < 0 (Т2 < Т1), то это положительный эффект Джоуля-Томсона (наблюдается для большинства газов при комнатной температуре).
2. Если газ при продавливании нагревался DТ > 0 (Т2 > Т1) – это отрицательный эффект Джоуля-Томсона (наблюдается для водорода и гелия при комнатной температуре).
3. Возможен и нулевой эффект Джоуля-Томсона, когда температура газа не изменяется.
Для количественной характеристикиэффекта вводится дифференциальный коэффициент Джоуля-Томсона m = DT/Dp, который, например для воздуха, составляет 0,25 град/атм.
Если давление и объём газа меняются незначительно, то это дифференциальный эффект Джоуля-Томсона.
В технике используют интегральный эффект Джоуля-Томсона (как сумма дифференциальных эффектов), при котором давление изменяется в широких пределах (до 100–200 атм).
Закон Джоуля
Внутренняя энергия тела (системы) (  ) — это один из важнейших параметров, которые характеризуют систему в термодинамике. Она является функцией состояния. В соответствии с молекулярно — кинетической теорией внутренняя энергия тела складывается из кинетической и потенциальной энергии атомов и молекул, составляющих тело (тела). Так, в идеальном газе его внутренняя энергия есть суммарная кинетическая энергия всех его молекул (атомов).
) — это один из важнейших параметров, которые характеризуют систему в термодинамике. Она является функцией состояния. В соответствии с молекулярно — кинетической теорией внутренняя энергия тела складывается из кинетической и потенциальной энергии атомов и молекул, составляющих тело (тела). Так, в идеальном газе его внутренняя энергия есть суммарная кинетическая энергия всех его молекул (атомов).
Свой закон относительно внутренней энергии идеального газа Джоуль установил в 1845 г.
Формулировка закона Джоуля
Внутренняя энергия идеального газа не зависит от объема и является функцией его температуры.
36. Адиабатический процесс. Уравнение Пуассона.
Адиабатический, процесс — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством. Адиабатические процессы обратимы только тогда, когда в каждый момент времени система остаётся равновесной (например, изменение состояния происходит достаточно медленно) и изменения энтропии не происходит.
Обратимый адиабатический процесс для идеального газа описывается уравнением Пуассона. Линия, изображающая адиабатный процесс на термодинамической диаграмме, называется адиабатой Пуассона. Примером необратимого адиабатического процесса может быть распространение ударной волны в газе. Такой процесс описывается ударной адиабатой.
Если термодинамический процесс в общем случае являет собой три процесса — теплообмен, совершение системой (или над системой) работы и изменение её внутренней энергии, то адиабатический процесс в силу отсутствия теплообмена ( 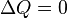 ) системы со средой сводится только к последним двум процессам. Поэтому,первое начало термодинамики в этом случае приобретает вид
) системы со средой сводится только к последним двум процессам. Поэтому,первое начало термодинамики в этом случае приобретает вид

где 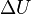 — изменениевнутренней энергии тела,
— изменениевнутренней энергии тела,  —работа, совершаемая системой.
—работа, совершаемая системой.
Изменения энтропии S системы в обратимом адиабатическом процессе вследствие передачи тепла через границы системы не происходит:
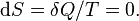
Здесь 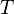 — температура системы,
— температура системы,  — теплота, полученная системой. Благодаря этому адиабатический процесс может быть составной частью обратимого цикла.
— теплота, полученная системой. Благодаря этому адиабатический процесс может быть составной частью обратимого цикла.
Адиабата Пуассона
Для идеальных газов, чью теплоёмкость можно считать постоянной, в случае квазистатического процесса адиабата имеет простейший вид и определяется уравнением
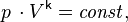
где 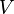 — егообъём,
— егообъём, 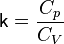 —показатель адиабаты,
—показатель адиабаты, 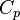 и
и 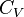 —теплоёмкости газа соответственно при постоянном давлении и постоянном объёме.
—теплоёмкости газа соответственно при постоянном давлении и постоянном объёме.
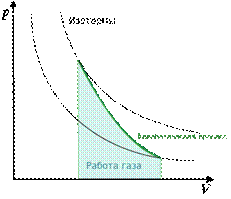
График адиабаты (жирная линия) на диаграмме для газа. 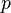 — давление газа;
— давление газа; 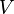 — объём.
— объём.
С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду
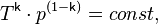
где 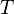 —абсолютная температура газа. Или к виду
—абсолютная температура газа. Или к виду
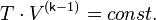
Поскольку 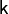 всегда больше 1, из последнего уравнения следует, что при адиабатическом сжатии (то есть при уменьшении
всегда больше 1, из последнего уравнения следует, что при адиабатическом сжатии (то есть при уменьшении 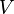 ) газ нагревается (
) газ нагревается ( 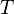 возрастает), а при расширении — охлаждается, что всегда верно и для реальных газов. Нагревание при сжатии больше для того газа, у которого больше коэффициент
возрастает), а при расширении — охлаждается, что всегда верно и для реальных газов. Нагревание при сжатии больше для того газа, у которого больше коэффициент 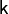 .
.
При адиабатическом процессе показатель адиабаты равен 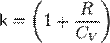 .
.
Для нерелятивистского невырожденного одноатомного идеального газа 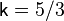 , для двухатомного
, для двухатомного 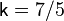 , для трёхатомного
, для трёхатомного 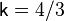 , для газов, состоящих из более сложных молекул, показатель адиабаты
, для газов, состоящих из более сложных молекул, показатель адиабаты 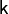 определяется числомстепеней свободы (i) конкретной молекулы, исходя из соотношения
определяется числомстепеней свободы (i) конкретной молекулы, исходя из соотношения 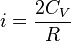 .
.
Для реальных газов показатель адиабаты отличается от показателя адиабаты для идеальных газов, особенно для низких температур, когда большую роль начинает играть межмолекулярное взаимодействие. Один из методов для экспериментального определения показателя был предложен в 1819 г. Клеманом и Дезормом. Стеклянный баллон вместимостью несколько литров наполняется исследуемым газом при давлении 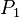 Затем открывается кран, газ адиабатически расширяется, и давление падает до атмосферного —
Затем открывается кран, газ адиабатически расширяется, и давление падает до атмосферного — 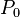 . Затем происходит егоизохорное нагревание до температуры окружающей среды. Давление повышается до
. Затем происходит егоизохорное нагревание до температуры окружающей среды. Давление повышается до 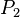 . В результате такого эксперимента k можно вычислить как
. В результате такого эксперимента k можно вычислить как 
37. Политропический процесс. Уравнение политропического процесса.
Так называется всякий процесс изменения состояния, при котором теплоемкость С остается постоянной и равной
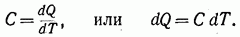
Найдем общее уравнение политропического процесса (уравнение политропы).
Согласно первому началу термодинамики
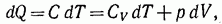
Или
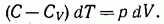
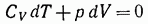
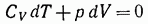


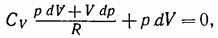
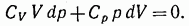
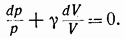
В предположении, что у постоянно, можно написать:
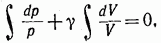
После интегрирования получаем 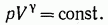
38. Скорость звука. (=343м/с)
Скорость звука, скорость распространения какой-либо фиксированной фазы звуковой волны; называется также фазовой скоростью, в отличие от групповой скорости. С. з. обычно величина постоянная для данного вещества при заданных внешних условиях и не зависит от частоты волны и её амплитуды. В тех случаях, когда это не выполняется и С. з. зависит от частоты, говорят о дисперсии звука.
Для газов и жидкостей, где звук распространяется обычно адиабатически (т. е. изменение температуры, связанное со сжатиями и разряжениями в звуковой волне, не успевает выравниваться за период), выражение для С. з. можно представить, как
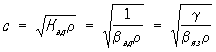 ,
,
где Кад — адиабатический модуль объёмного сжатия, r — плотность, bад — адиабатическая сжимаемость, bиз = gbад — изотермическая сжимаемость, g = cp/cv —отношение теплоёмкостей при постоянном давлении cp и при постоянном объёме cv .
В идеальном газе С. з.
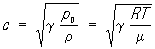
(формула Лапласа), где r0 — среднее давление в среде, R — универсальная газовая постоянная, Т — абсолютная температура, m — молекулярный вес газа. При g= 1 получаем формулу Ньютона для С. з., соответствующую предположению об изотермическом характере процесса распространения. В жидкостях обычно можно пренебречь различием между адиабатическим и изотермическим процессами.
С. з. в изотропных твёрдых телах определяется модулями упругости вещества и его плотностью. В неограниченной твёрдой среде распространяются продольные и сдвиговые (поперечные) волны, причём фазовая С. з. для продольной волны равна
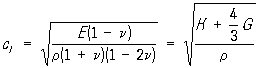 ,
,
а для сдвиговой
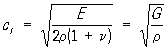
где Е — модуль Юнга, G — модуль сдвига, g — коэффициент Пуассона, К — модуль объёмного сжатия. Скорость распространения продольных волн всегда больше, чем скорость сдвиговых волн
39. Идеальная и вязкая жидкость. Уравнение Бернулли.
Идеальнойназывают такую жидкость, которая не обладает свойствами температурного расширения, сжимаемости и вязкости, т.е. имеет идеальную подвижность. В природе таких жидкостей не существует и понятие идеальной жидкости введено для упрощения решения ряда гидравлических задач.
Реальная (вязкая) жидкость отличается от идеальной прежде всего тем, что при ее движении возникают касательные напряжения (внутреннее трение). В покоящейся нормальной жидкости касательные напряжения всегда отсутствуют, поэтому в гидростатике нет необходимости различать реальную и идеальную жидкости.
Ньютоновскими называют жидкости, для которых вязкость не зависит от скорости деформации. В уравнении Навье — Стокса для ньютоновской жидкости имеет место аналогичный вышеприведённому закон вязкости (по сути, обобщение закона Ньютона, или закон Навье)
Основные уравнения гидродинамики - уравнение Бернулли и неразрывности позволяют установить взаимосвязь между параметрами плавно изменяющегося потока.
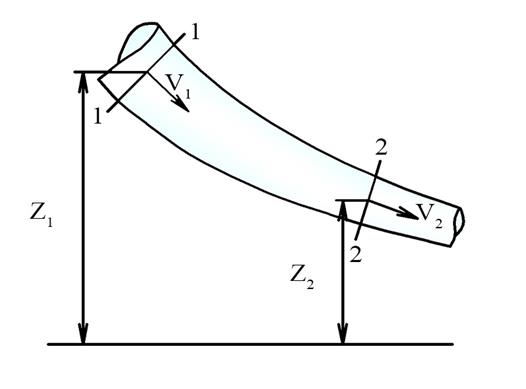
Запишем для этого случая уравнение, связывающее между собой скорость движения жидкости и ее давление в каждом сечении.
z1 + (p1/ρg) + (V12/2g) = z2 + (p2/ρg) + (V22/2g)
- где z - геометрическая высота,
- p - давление в выбранном сечении,
- V - скорость жидкости в выбранном сечении,
- ρ - плотность жидкости,
- g - ускорение свободного падения.
Указанное уравнение называют законом или уравнением Бернулли для элементарной струйки идеальной несжимаемой жидкости.
Для каждого рассматриваемого сечения полный напор есть сумма геометрического, пьезометрического и скоростного напора. Для идеальной жидкости (т.е. при отсутствии потерь энергии) полный напор - величина постоянная.
z + p/ ρ g + V2/2g = Н = const
- где z - геометрический напор,
- p/ρg - пьезометрический напор,
- z + p/ρg - статический напор,
- V2/2g - скоростной напор,
- z + p/ρg + V2/2g = Н - полный напор.
Уравнение Бернулли можно записать и в другом виде, умножим обе части уравнения на g получим:
gz1 + p1/ρ + V12/2 = gz2 + p2/ρ + V22/2
40. Второе начало термодинамики. Коэффициент полезного действия.
Второе начало термодинамики:1)теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому. Под теплотой понимается внутренняя энергия тела
2)Невозможен процесс, единственным результатом которого является превращение теплоты в работу.
3)Невозможно построить машину, все действия которой сводились бы к производству работы за счет охлаждения теплового источника (вечный двигатель второго рода.
Второе начало термодинамики дает возможность определить, какой из процессов будет протекать самопроизвольно, какое количество работы может быть при этом получено, каков предел самопроизвольного течения процесса;оно применимо лишь к макроскопическим системам
Отношение работы А, совершенной тепловой машиной, к количеству теплоты Q1, полученному от нагревателя, называется термодинамическим коэффициентом полезного действия (КПД) машины η 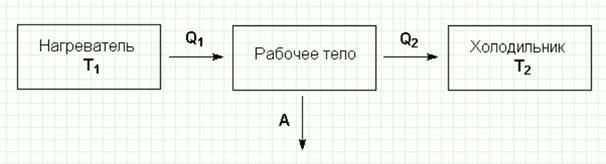
41. Цикл Карно. Теорема Карно ( I теорема Карно).
В термодинамике цикл Карно́ или процессмКарно — это идеальный круговой процесс, состоящий из двух адиабатных и двух изотермических процессов.
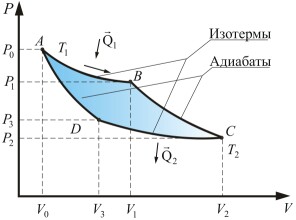
Первая теорема Карно. КПД обратимого цикла Карно, осуществляемого между двумя источниками теплоты, не зависит от свойств рабочего вещества, с помощью которого этот цикл осуществляется. 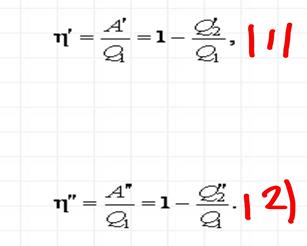
42. Цикл Карно для идеального газа. Коэффициент полезного действия цикла Карно для идеального газа.
При проведении каждого отдельного процесса равновесного цикла Карно с идеальным газом в обратном направлении не только рабочее тело совершает цикл, но и источники теплоты (нагреватель и холодильник) остаются практически в исходном состоянии(если они очень велики по сравнению с рабочим телом). Поэтому мы называем цикл Карно с идеальным газом обратимымциклом 
|
из
5.00
|
Обсуждение в статье: Макроскопическая работа. Внутренняя энергия. Количество теплоты. Первое начало термодинамики. Следствия из первого начала термодинамики. Энтальпия. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

