 |
Главная |
Задания для самостоятельной подготовки
|
из
5.00
|
1. Для предложенных соединений:
· укажите их класс;
· напишите уравнения возможных реакций взаимодействия
с H2O, K2O, SO3, HCl, NaOH.
| 1 | ZnO, KOH, H2CO3 | 16 | BеO, P2O5, H2S |
| 2 | CaO, HNO3, Sn(OH)2 | 17 | H2O, HMnO4, Cr(OH)3 |
| 3 | Al2O3, Ca(OH)2, H2SiO3 | 18 | Li2O, Ca(OH)2, H3PO4 |
| 4 | SiO2, H3PO4, Pb(OH)2 | 19 | SeO2, HBr, Pb(OH)2 |
| 5 | SO2, H2SO4, Al(OH)3 | 20 | BeO, H2Se, Ga(OH)3 |
| 6 | PbO, Ba(OH)2, H2S | 21 | Al2O3, H3PO4, KOH |
| 7 | SiO2, Fe(OH)3, HI | 22 | SO3, Cd(OH)2, HNO3 |
| 8 | BaO, Cd(OH)2, Be(OH)2 | 23 | CuO, H2SiO3, Ni(OH)2 |
| 9 | N2O5, HF, Cr(OH)3 | 24 | NiO, H2SO4, Cr(OH)3 |
| 10 | HNO3, Cr2O3, Sr(OH)2 | 25 | Na2O, H2SO3, N2O5 |
| 11 | Fe2O3, H2SO3, Cd(OH)2 | 26 | Li2O, Mg(OH)2, H2CO3 |
| 12 | Cr2O3, H2SO3, Ca(OH)2 | 27 | Cl2O, Cd(OH)2, HNO3 |
| 13 | P2O5, KOH, Al(OH)3 | 28 | SO2, H2SO4, Cr(OH)3 |
| 14 | CO2, Cu(OH)2, HF | 29 | HNO3, KOH, Cd(OH)2 |
| 15 | Na2O, HNO3, Be(OH)2 | 30 | H2CO3, Sn(OH)2, NH4OH |
2. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
| 1 | SnCl2 ® SnOHCl ® SnCl2 ® Sn(OH)2 ® Na2SnO2 |
| 2 | Na2BeO2 ® Be(OH)2 ® BeSO4 ® Be(NO3)2 ® Be(OH)2 |
| 3 | H2CO3 ® K2CO3 ® KHCO3 ® K2CO3 ® MgCO3 |
| 4 | H2SO3 ®K2SO3 ® KHSO3 ®K2SO3 ® Н2SO3 |
| 5 | Al(OH)3 ® Al2(SO4)3 ® AlOHSO4 ® Al(OH)3 ® KAlO2 |
| 6 | FeCl3 ® Fe(OH)3 ® FeCl3 ® Fe(OH)2Cl |
| 7 | H2CO3 ® NaHCO3 ® Na2CO3 ® NaHCO3 ® H2CO3 |
| 8 | NaOH ® Na2SO3 ® NaHSO3 ® Na2SO3 ® H2SO3 |
| 9 | Ca(OH)2 ® Ca3(PO4)2 ® CaHPO4 ® Ca3(PO4)2 ® CaCl2 |
| 10 | H2SO3 ® CaSO3 ® Ca(HSO3)2 ® CaSO3 ® H2SO3 |
| 11 | H3PO4 ® NaH2PO4 ® Na3PO4 ® Na2HPO4 ® H3PO4 |
| 12 | AlOHSO4 ®Al(OH)3 ®Al2(SO4)3 ® Al(OH)3 ® NaAlO2 |
| 13 | H2SiO3 ® Na2SiO3 ® CaSiO3 ® H2SiO3 ® К2SiO3 |
| 14 | Mg(OH)2 ® MgCl2 ®MgOHCl ® MgCl2 ®Mg(OH)2 |
| 15 | NaOH ® Na3PO4 ® NaH2PO4 ® H3PO4 ® Na3PO4 |
| 16 | Ca(OH)2®Ca3(PO4)2 ®CaHPO4 ®Ca(H2PO4)2 ®Ca3(PO4)2 |
| 17 | NiSO4 ® (NiOH)2SO4 ® Ni(OH)2 ®NiOHCl ®Ni(OH)2 |
| 18 | Fe(OH)3 ® Fe2(SO4)3 ® FeOHSO4 ® Fe2(SO4)3 ® (Fe(OH)2)2SO4 |
| 19 | CuCl2 ® Cu(OH)2 ® CuSO4 ® CuS ® Cu(NO3)2 |
| 20 | Cr(OH)3 ® Cr2(SO4)3 ®CrOHSO4 ® Cr(OH)3 ® KCrO2 |
| 21 | Ca(OH)2 ®CaCO3 ® Ca(HCO3)2 ®CaCl2 ® Ca(NO3)2 |
| 22 | K2PbO2 ®Pb(OH)2 ®PbOHCl ® PbCl2 ® Pb(OH)2 |
| 23 | CoOHCl ® CoCl2 ® Co(OH)2 ® Co(NO3)2 ® CoOHNO3 |
| 24 | KOH ® K2SiO3 ® H2SiO3 ® Na2SiO3 ® H2SiO3 |
| 25 | Zn(OH)2 ® K2ZnO2 ®Zn(OH)2 ® ZnSO4 ® Zn(OH)2 |
| 26 | Ba3(PO4)2 ® BaHPO4 ® Ba3(PO4)2 ® H3PO4 ® Na3PO4 |
| 27 | CuSO4 ® Cu(OH)2 ® CuCl2 ® CuOHCl ® CuCl2 |
| 28 | (NiOH)2SO4 ® Ni(OH)2 ® NiCl2 ® NiOHCl ® Ni(OH)2 |
| 29 | Al(OH)3 ® AlOHCl2 ® Al(OH)3 ® Al(OH)2Cl ® Al(OH)3 |
| 30 | Sr(OH)2 ® SrCO3 ® Sr(HCO3)2 ® SrCO3 ® Sr(NO3)2 |
ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
Химическая термодинамика – раздел химии, изучающий:
· переход энергии из одной формы в другую, от одной части системы к другой;
· энергетические эффекты химических реакций;
· возможность и направление самопроизвольного протекания процессов.
Состояние системы характеризуют параметры – давление, объем, температура, концентрация и др. Термодинамические свойства системы при постоянных давлении и температуре можно выразить с помощью нескольких функций состояния системы: энтальпии, энтропии, энергии Гиббса и др.
Для удобства сопоставления термодинамических констант их относят к стандартному состоянию. В качестве стандартного выбрано устойчивое состояние чистых индивидуальных веществ (для растворов – концентрация растворенного вещества 1 моль/л, для газов – парциальное давление, равное атмосферному) при постоянной температуре и давлении 101кПа (1 атм).
Энтальпия
Количество выделившейся или поглощенной в ходе реакции энергии называют тепловым эффектом химической реакции.
В термодинамике тепловой эффект или энтальпия химической реакции (DH Х.Р ) – теплота, которая выделяется или поглощается при ее протекании, если р, Т = const; измеряется в кДж.
Уравнения реакций, в которых указаны тепловые эффекты при постоянных давлении и температуре (DH Х.Р ), называются термохимическими. В термохимических уравнениях указывают также модификации или агрегатные состояния веществ.
В соответствии со знаком теплового эффекта реакции можно разделить на две группы:
· экзотермические – идут с выделением тепла (DH Х.Р < 0);
· эндотермические – идут с поглощением тепла (DH Х.Р > 0).
Согласно основному закону термохимии, сформулированному Г. И. Гессом:
· энтальпия химической реакции не зависит от пути протекания реакции, т. е. не зависит от числа и характера промежуточных стадий, а определяется лишь начальным и конечным состоянием системы.
Следствие из закона Гесса:
· тепловой эффект химической реакции ( 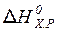 ) равна разности между суммами энтальпий образования продуктов реакции (
) равна разности между суммами энтальпий образования продуктов реакции (  ) и исходных веществ (
) и исходных веществ (  ) c учетом стехиометрических коэффициентов (n , m). Как правило, для расчетов используют стандартные величины.
) c учетом стехиометрических коэффициентов (n , m). Как правило, для расчетов используют стандартные величины.

Стандартная энтальпия (теплота) образования вещества D Hобр.0 или D Н f0 [кДж/моль] – это теплота образования 1 моль соединения из простых веществ устойчивых при стандартных условиях.
DHобр0 простых веществ (H2, O2, Cl2 и т. д.) равна нулю.
Энтропия
Энтропия (S) является мерой неупорядоченности системы. Энтропия вещества в стандартном состоянии называется стандартной энтропией S0 и измеряется в Дж/(моль·К).
· Стандартное изменение энтропии химической реакции (  ) равно разности между суммами энтропий продуктов (
) равно разности между суммами энтропий продуктов (  ) и исходных веществ (
) и исходных веществ (  ) с учетом стехиометрических коэффициентов (n , m):
) с учетом стехиометрических коэффициентов (n , m):

S0 простых веществ (H2, O2, Cl2 и т. д.) не равна нулю.
|
из
5.00
|
Обсуждение в статье: Задания для самостоятельной подготовки |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

