 |
Главная |
Основные принципы распределения электронов в атомах
|
из
5.00
|
СТРОЕНИЕ АТОМА
Атом представляет собой сложную систему находящихся в движении и взаимодействии элементарных частиц. Он состоит из положительно заряженного ядра, в котором заключена основная его масса, отрицательно заряженных электронов. Заряд ядра равен числу содержащихся в нем протонов (Z) и соответствует порядковому номеру элемента в периодической системе. Его указывают слева внизу у символа элемента, например, 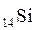 (Z = 14).
(Z = 14).
Число электронов в атоме равно заряду его ядра, а, следовательно, совпадает с порядковым номером элемента в периодической системе.
Суммарное число протонов и нейтронов соответствует массовому числу атома (A) ( 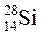 ; А=28).
; А=28).
Число нейтронов (N) вычисляется по формуле
N = A – Z ,
где А – массовое число атома.
Энергетическое состояние электронов в атоме
Энергетическое состояние электронов в атоме характеризуют четыре квантовых числа: n , l , ml , s .
n – главное квантовое число – характеризует энергию электрона в зависимости от удаленности его от ядра; n определяет номер энергетического уровня и может принимать целочисленные значения:
n = 1, 2, 3, 4, 5, 6, 7…
l – орбитальное или азимутальное квантовое число – характеризует энергию электрона в зависимости от формы орбитали. Область пространства, в котором наиболее вероятно нахождение электрона, называется его орбиталью.
l может принимать целочисленные значения в интервале от 0 до (n–1), где n – главное квантовое число.
Если n = 1 (первый уровень), то l = 0, т.е. существует один подуровень. Если n = 2, то l принимает два значения: l = 0 и l = 1, т.е. два подуровня, если n = 3, то l = 0, 1, 2, если n = 4, то l = 0, 1, 2, 3, т. е. число подуровней равно номеру уровня. Каждому значению l соответствует определенная форма орбитали.
Подуровни имеют буквенное обозначение:
| Значение орбитального квантового числа, l | 0 | 1 | 2 | 3 |
| Обозначение подуровня (орбитали) | s | p | d | f |
s-орбитали имеют сферическую форму; р-орбитали ‑ правильной объемной восьмерки. Более сложную форму имеют d- и f-орбитали. Схематично орбиталь обозначают одной квантовой ячейкой
ml – магнитное квантовое число – характеризует энергию электрона в зависимости от ориентации орбитали в пространстве. Число значений ml определяют по формуле (2 l + 1), ml принимает значения – l ...0...+ l.
Если l = 0 (s-подуровень), то ml = 0 (одно значение ml), т.е. s-орбиталь имеет одну ориентацию в пространстве
Для l = 2 (р-подуровень) ml = +1, 0, –1 (три значения ml), т.е. р-орбитали направлены в пространстве по трем координатным осям. Это обозначается тремя квантовыми ячейками
Для d -орбиталей возможно 5 ориентаций в пространстве (5 квантовых ячеек) , для f-орбитали –семь .
s – спиновое квантовое число – характеризует энергию электрона в зависимости от вращения его вокруг своей собственной оси, s принимает значения +1/2 или –1/2. Условно электрон обозначают стрелкой ↑ (s = +1/2) или ↓ (s = –1/2).
Основные принципы распределения электронов в атомах
Принцип Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. Отсюда следует, что на каждой орбитали не может быть больше двух электронов, при этом они должны иметь антипараллельные спины.
Пример: верно неверно
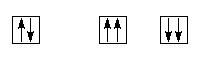
Принцип Паули позволяет рассчитать максимальное число электронов на подуровне, а следовательно, и на уровне. Например, на р-подуровне, имеющем три орбитали, максимально возможно шесть электронов. Максимальное число электронов на уровне определяется формулой 2n2, где n – главное квантовое число. Поэтому на первом уровне (n = 1) максимальное число электронов ‑ два, во втором – восемь, в третьем – восемнадцать и т.д.
Правило Гунда: когда атом находится в устойчивом состоянии, электроны в пределах подуровня располагаются таким образом, чтобы сумма спиновых квантовых чисел была максимальной. В соответствии с этим правилом заполнение орбиталей одного подуровня в устойчивом состоянии начинается электронами с одинаковыми спинами, после того как одиночные электроны займут все орбитали в данном подуровне, происходит заполнение орбиталей вторыми электронами с противоположными спинами.
Например, р-электроны в пределах подуровня необходимо распределять следующим образом:
р3 р4 р5
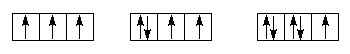
Принцип наименьшей энергии: электроны заполняют в атоме в первую очередь орбитали с меньшей энергией. Последовательность заполнения атомных орбиталей электронами зависит от значений главного (n) и орбитального (l) квантовых чисел. Эту зависимость установил В. М. Клечковский, который сформулировал следующие правила.
1. Электроны последовательно заполняют орбитали от меньших значений суммы (n + l) к орбиталям с большим значением этой суммы.
2. Если для двух орбиталей суммы (n + l) оказываются одинаковыми, то в первую очередь заполняются орбитали с меньшим значением n.
В соответствии с этим правилом последовательность заполнения подуровней:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<5d≈4f<6p<7s<6d≈5f.
|
из
5.00
|
Обсуждение в статье: Основные принципы распределения электронов в атомах |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

