 |
Главная |
Энергия Гиббса и ее изменение в ходе химических реакций
|
из
5.00
|
С точки зрения термодинамики в химических процессах появляются две тенденции:
· стремление к образованию связей между частицами, к возникновению более сложных агрегатов, сопровождающееся понижением энергии системы, снижением энтальпии;
· стремление к беспорядочному расположению частиц, их разъединению, характеризуемое увеличением энтропии.
Каждая их этих противоположных тенденций, количественно выражаемая значениями ΔH и ΔS, зависит от природы веществ и условий протекания процесса (температура, давление, соотношение между реагентами и др.).
В условиях постоянных давления и температуры, функцией, сопоставляющей эти тенденции, является энергия Гиббса или изобарно-изотермический потенциал, измеряется в кДж/моль:
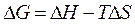 .
.
· Стандартное изменение энергии Гиббса химической реакции равно разности между суммами изменения энергии Гиббса образования продуктов и исходных веществ с учетом стехиометрических коэффициентов:

DG0 простых веществ равно нулю.
Изменение энергии Гиббса характеризует возможность и направление самопроизвольного протекания процессов:
·  > 0 – реакция может самопроизвольно протекать в обратном направлении;
> 0 – реакция может самопроизвольно протекать в обратном направлении;
·  < 0 – реакция может самопроизвольно протекать в прямом направлении;
< 0 – реакция может самопроизвольно протекать в прямом направлении;
·  = 0 – система находится в состоянии равновесия.
= 0 – система находится в состоянии равновесия.
Если пренебречь зависимостями DН и DS от температуры и считать их постоянными, можно рассчитать  при нестандартной температуре. Исходя из этого можно рассчитать температуру, при которой устанавливается состояние равновесия:
при нестандартной температуре. Исходя из этого можно рассчитать температуру, при которой устанавливается состояние равновесия:

Если в ходе расчетов значение температуры установления состояния равновесия имеет отрицательное значение (по шкале Кельвина), можно сделать вывод, что состояние равновесия в системе недостижимо, реакция во всем температурном интервале может самопроизвольно протекать либо в прямом, либо в обратном направлении.
Проанализируем зависимость  . Если пренебречь зависимостями величин D H и D S от температуры, то
. Если пренебречь зависимостями величин D H и D S от температуры, то  является уравнением прямой. Возможны четыре варианта расположения прямой по отношению к осям координат в зависимости от знаков D H и D S (рис. 1).
является уравнением прямой. Возможны четыре варианта расположения прямой по отношению к осям координат в зависимости от знаков D H и D S (рис. 1).

Рис. 1. График зависимости  от температуры
от температуры
1. D H < 0, D S < 0. Прямые реакции термодинамически возможны (D G Х.Р < 0) при температурах до Т/, при температурах свыше Т/ (D G Х.Р > 0) возможны обратные реакции.
2. D H > 0, D S > 0. Прямые реакции термодинамически возможны (D G Х.Р < 0) при температурах свыше Т/, при температурах до Т/ возможны обратные реакции.
3. D H > 0, D S < 0. Во всем диапазоне температур значение D G Х.Р > 0, т.е. прямые реакции термодинамически невозможны при любых температурах.
4. D H < 0, D S > 0. Во всем диапазоне температур значение D G Х.Р < 0, т.е. прямые реакции термодинамически возможны при любых температурах.
|
из
5.00
|
Обсуждение в статье: Энергия Гиббса и ее изменение в ходе химических реакций |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

