 |
Главная |
IV . Термодинамический анализ основной реакции
|
из
5.00
|
При проектировании технологических процессов важное место занимают термодинамические расчеты химических реакций.
Цель термодинамического анализа заключается в определении принципиальной возможности проведения химической реакции в данных условиях, в выборе условий проведения процесса.
Задание: Для основной реакции необходимо рассчитать константу равновесия по термодинамическим данным (тепловой эффект реакции, изменение энтропии, свободную энергию Гиббса (изобарно-изотермический потенциал)).
Дано:

Таблица 7. Термодинамические свойства веществ – участников реакции
| Вещество |
|
|
| Ср = f(Т) | |||
| а | в*103 | c*106 | c’*10-5 | ||||
| С6Н12 | -123,1 | 298,2 | 106,3 | 51,72 | 598,8 | -230,0 | – |
| О2 | 0 | 205,04 | 29,37 | 31,46 | 3,39 | – | -3,77 |
| С6Н10О | -198 | 296 | – | 3,08 | 565 | 300 | – |
| Н2О | -241,81 | 188,72 | 33,61 | 30,00 | 10,71 | – | 0,33 |
Таблица 8. Данные термодинамического расчета
| Т, ºС | 40 | 90 | 140 | 190 | 240 | 290 | 340 | 390 | 440 | 490 | 540 |
| К | 313 | 363 | 413 | 463 | 513 | 563 | 613 | 663 | 713 | 763 | 813 |
Рассчитаем тепловой эффект реакции при атмосферном давлении в заданном температурном интервале.





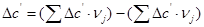
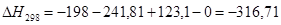




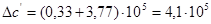
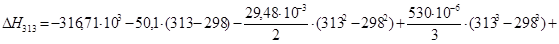
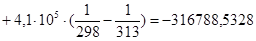
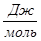


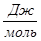


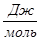
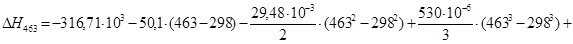




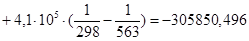
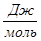
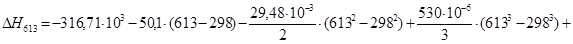
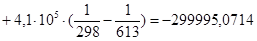
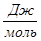


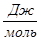


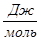

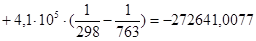
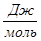
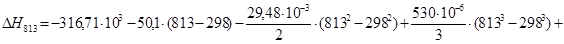
Рассчитаем изменение энтропии при атмосферном давлении в заданном температурном интервале:



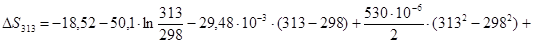



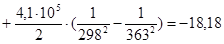


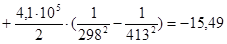

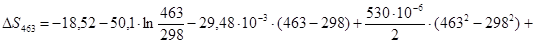

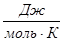


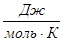


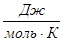




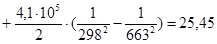


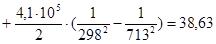







Рассчитаем изменение изобарно-изотермического потенциала (энергии Гиббса) в заданном температурном интервале:



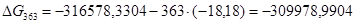







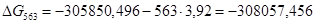




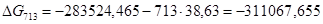

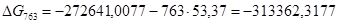


Рассчитаем логарифм константы равновесия в заданном температурном интервале используя уравнение изотермы Вант-Гоффа:



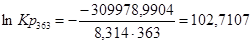
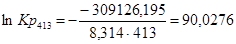








Рассчитаем константы равновесия в заданном температурном интервале:
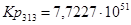








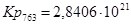

Полученные данные сведем в таблицу:
Таблица 9. Зависимость термодинамических функций от температуры
| Т, К | 
| 
| 
| ln Kp | Кр |
| 313 | -316788,5328 | -18,78 | -310910,3928 | 119,4761 | 
|
| 363 | -316578,3304 | -18,18 | -309978,9904 | 102,7107 | 
|
| 413 | -315523,5650 | -15,49 | -309126,1950 | 90,0276 | 
|
| 463 | -313477,5833 | -10,83 | -308463,2933 | 80,1332 | 
|
| 513 | -311452,4869 | -4,34 | -309226,0669 | 72,5018 | 
|
| 563 | -305850,4960 | 3,92 | -308057,4560 | 65,8132 | 
|
| 613 | -299995,0714 | 13,87 | -308497,3814 | 60,5314 | 
|
| 663 | -292597,8560 | 25,45 | -309471,2060 | 56,1431 | 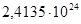
|
| 713 | -283524,4650 | 38,63 | -311067,6550 | 52,4753 | 
|
| 763 | -272641,0077 | 53,37 | -313362,3177 | 49,3983 | 
|
| 813 | -259813,9353 | 69,64 | -316431,2553 | 46,8143 | 
|
4.7. На основании полученных данных построим графики:

Рис. 1. Зависимость теплового эффекта реакции от температуры.

Рис. 2. Зависимость энтропии реакции от температуры.
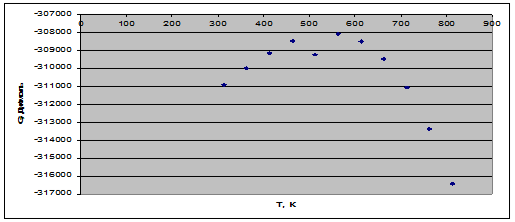
Рис. 3. Зависимость энергии Гиббса от температуры.

Рис. 4. Зависимость логарифма константы равновесия от обратной температуры.




613 – -299995,0714
х– -299304
 К
К
Выводы: Рассчитав термодинамические величины, получили:
1) Реакция является экзотермической на всем температурном интервале, т.к.  .
.
2) Для проведения процесса оптимальной считается температура 3390С (612 К).
3) С увеличением температуры изменение энтропии в ходе процесса увеличивается.
4) На всем температурном интервале  , следовательно, реакция идет самопроизвольно.
, следовательно, реакция идет самопроизвольно.
5) Кр>>1, следовательно, реакция смещена в прямом направлении (в сторону образования продуктов), т.к. Кр больше 1020 реакция является необратимой.
|
из
5.00
|
Обсуждение в статье: IV . Термодинамический анализ основной реакции |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы





