 |
Главная |
V. Расчет константы равновесия и равновесного состава реагирующих веществ
|
из
5.00
|
Для количественной оценки интенсивности работы различных аппаратов и для технологического расчета производственных процессов используют константу скорости процесса.
Скорость процесса определяет производительность аппарата.
Константа скорости химической реакции представляет собой сложную величину, которая зависит не только от химических свойств реагирующих веществ, но и от их физических характеристик, конструкции аппарата, гидродинамических условий проведения процесса, диффузии реагирующих веществ и продуктов реакции.
Задание: По основной реакции и вычисленной константе равновесия в заданном температурном интервале рассчитать равновесный состав реакционной массы.
Дано:
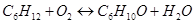
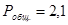
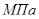
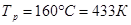
Рассчитаем константы равновесия в заданном температурном интервале используя уравнение изотермы Вант-Гоффа:
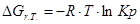
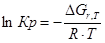
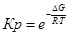
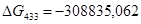
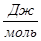
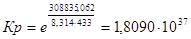
Выразим константы уравнения через парциальные давления:
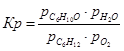
Выразим парциальные давления веществ, участвующих в реакции, через мольные дли вещества:
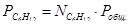
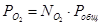
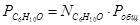
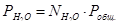
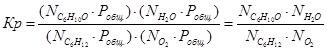
Чтобы найти мольные доли веществ составим таблицу молей веществ в состоянии равновесия:
Таблица 10. Мольные доли веществ в состоянии равновесия
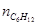
| 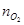
| 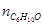
| 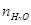
| |
| Исходная смесь | 0,26 | 0,52 | – | – |
| Образовалось | – | – | х | х |
| Израсходовалось | х | х | – | – |
| Осталось в состоянии равновесия | 0,26-х | 0,52-х | х | х |
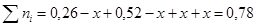
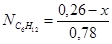
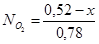
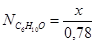
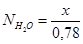
Полученные значения мольных долей подставляем в уравнение константы равновесия:
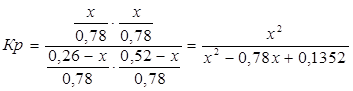
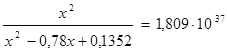
х=0,26
Отсюда находим значение мольных долей:
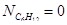
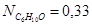

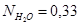
Вывод: Таким образом, в ходе проведенных расчетов установили, что в момент равновесия мольная доля вещества составляет 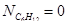 (т.е. циклогексан полностью израсходовался),
(т.е. циклогексан полностью израсходовался), 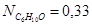 ,
,  ,
, 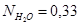 . Из этих данных видно, что равновесие смешено в сторону прямой реакции, и практически полностью израсходованы вещества.
. Из этих данных видно, что равновесие смешено в сторону прямой реакции, и практически полностью израсходованы вещества.
VI . Эмпирический расчет теплот сгорания и образования веществ
Задание: Данный пункт рассчитываем для веществ участников основной реакции. Из данных материального баланса выбрать три органических вещества и рассчитать теплоты сгорания по Коновалову и Карашу и определить наиболее точный метод расчета для конкретного вещества. Для этих же веществ рассчитать теплоты образования по энергиям связи. Дано:
Основная реакция
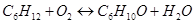
Побочная реакция
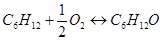
Определим теплоты сгорания веществ находящихся в газообразном состоянии по уравнению Коновалова
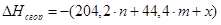
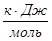
а) для С6Н12

n=18
m=6
x=0 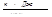
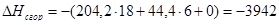
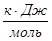 или
или 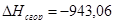
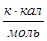
б) для С6Н10О
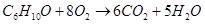
n=16
m=5
x=50,2 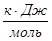
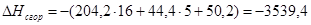
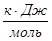 или
или 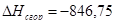
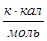
в) для С6Н12О
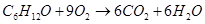
n=18
m=6
x=50,2 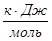
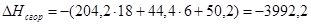
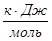 или
или 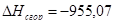
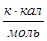
г) для С6Н6
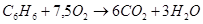
n=15
m=3
x=100,41 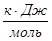
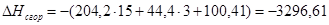
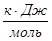 или
или 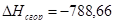
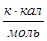
Результаты расчетов сводим в таблицу:
Таблица 11. Результаты расчета теплот сгорания по Коновалову
| Вещество | 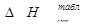
| 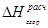
| 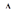
|
| С6Н12 | -944,79 | -943,06 | 0,2 |
| С6Н10О | -846,75 | ||
| С6Н12О | -890,70 | -955,07 | 7 |
| С6Н6 | -789,08 | -788,66 | 0,05 |
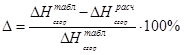
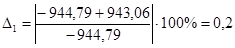
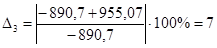
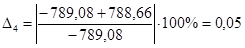
|
из
5.00
|
Обсуждение в статье: V. Расчет константы равновесия и равновесного состава реагирующих веществ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

